
【题目】铝粉与某些金属氧化物组成的混合物叫铝热剂,铝热剂在高温下发生的反应叫铝热反应.如:2Al+Fe2O3![]() 2Fe+Al2O3,反应发生时放出大量的热.仔细阅读上述信息回答下列问题:
2Fe+Al2O3,反应发生时放出大量的热.仔细阅读上述信息回答下列问题:
(1)“铝热反应”属于四大基本反应类型中的________反应.
(2)信息中的“某些”反应指________(填“比铝活泼的”、“比铝稳定的”或“任意”)金属.
(3)试写出铝粉与MnO2发生的铝热反应方程式________________________________.
(4)题给的铝热反应可用于野外焊接钢轨,试说明其原因:_____________.
【答案】置换 比铝稳定 3MnO2+4Al![]() 3Mn+2Al2O3 反应放出大量的热,将生成的铁熔化为铁水渗入铁轨缝隙
3Mn+2Al2O3 反应放出大量的热,将生成的铁熔化为铁水渗入铁轨缝隙
【解析】
(1)根据置换反应特点进行判断;
(2)铝为活泼金属,可以置换出比铝活泼性弱的金属;
(3)铝粉与MnO2在高温下反应生成Mn和Al2O3,
(4)反应放出大量的热,将生成的铁熔化为铁水渗入铁轨缝隙。
(1)单质与化合物反应生成新的单质和新的化合物,属于置换反应,“铝热反应”属于四大基本反应类型中的置换反应;
综上所述,本题答案是:置换。
(2) 反应为置换反应,应为活泼金属置换出较不活泼金属;所以信息中的“某些”反应指比铝稳定的金属;
综上所述,本题答案是:比铝稳定。
(3) 铝粉与MnO2在高温下反应生成Mn和Al2O3,反应的方程式为![]() ;综上所述,本题答案是:
;综上所述,本题答案是:![]() 。
。
(4) 铝热反应放出大量的热,该温度高于铁的熔点,从而使铁熔化, 铁水渗入铁轨缝隙中,可用于焊接钢轨;
综上所述,本题答案是:反应放出大量的热,将生成的铁熔化为铁水渗入铁轨缝隙。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】新制氯水的成分复杂,但饱和氯水久置后,成分发生变化,下列粒子①Cl2;②H2O;③Cl-;④HClO;⑤ H+,因饱和氯水久置而减少的是
A. ①②③ B. ①④ C. ②④ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,p、q、m、n分别为常见的气体单质,p和s均为有色气体,q能在p中燃烧并产生苍白色火焰,v的水溶液呈碱性,t的水溶液呈酸性。回答下列问题:
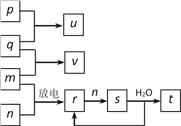
(1)新制p的水溶液中,除H2O、H+、OH-外,还含有____________等粒子(填化学式),该溶液中发生反应的离子方程式是___________。
(2)取2份新制p的水溶液,向第一份中滴入紫色石蕊溶液,现象是____________;第二份先滴入FeCl2溶液,后加入KSCN溶液,其现象是_____________,有关反应的离子方程式为_______________、_________________。
(3)反应“v+n→r”的化学方程式是__________,每转移2 mol电子,可生成标准状况下的r气体________L。s溶于水的反应中,氧化剂与还原剂的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三种溶液,可能是KCl、NaBr、KI.向甲中加入淀粉溶液和氯水,溶液变为橙色,再加入丙,颜色无明显变化,则甲、乙、丙依次含有( )
A.NaBr、KCl、KI
B.NaBr、KI、KCl
C.KI、NaBr、KCl
D.KCl、KI、NaBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年来关于氮污染的治理倍受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
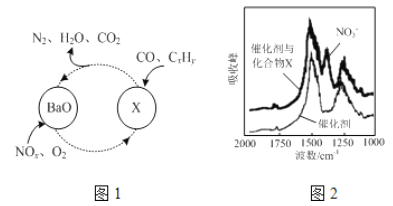
①在图示的转化中,被还原的元素是_______________,X的化学式为__________________。
②钡元素在周期表中的位置是___________________________。
(2)SCR技术可使NOx与NH3直接反应,实现无害转化。当NO与NO2的物质的最之比为2:1时,写出发生反应的化学方程式:____________________________。
(3)利用ClO2氧化氮氧化物反应过程如下:NO![]() NO2
NO2![]() N2反应I的化学方程式是2NO+ ClO2+H2O==NO2+HNO3+ 2HCl,反应II的离子方程式是__________________。
N2反应I的化学方程式是2NO+ ClO2+H2O==NO2+HNO3+ 2HCl,反应II的离子方程式是__________________。
(4)加入过量次氯酸钠可使废水中NH4+完全转化为N2,而本身被还原为NaCl。
①检验废水中是否存在NH4+的方法是_______________________________________________。
②若处理废水产生了0.448LN2 (标准状况),则需消耗浓度为2mol/L的次氯酸钠的体积为____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝镁合金已成为轮船制造、化工生产等行业的重要材料。某研究性学习小组的三位同学,为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计下列三种不同实验方案进行探究。填写下列空白。
探究一
实验方案:铝镁合金![]() 测定剩余固体质量。实验中发生反应的化学方程式是_______________________________________。
测定剩余固体质量。实验中发生反应的化学方程式是_______________________________________。
实验步骤:
(1)称取5.4 g铝镁合金粉末样品,投入V mL 2.0 mol/L NaOH溶液中,充分反应。为保证合金充分反应,NaOH溶液的体积V≥________。

(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将________(填“偏高”或“偏低”)。
探究二
实验方案:铝镁合金![]() 测定生成气体的体积(实验装置如图所示,),问题讨论:
测定生成气体的体积(实验装置如图所示,),问题讨论:
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置。你的意见是________(填“需要”或“不需要”)。
(2)为使测定结果尽可能精确,实验中应注意的问题是(写出两点):
①______________________________________,
②______________________________________。
探究三
实验方案:称量x g铝镁合金粉末,放在装有足量氧气的容器中惰性电热板上,通电使其充分灼烧。
问题讨论:
(1)欲计算Mg的质量分数,该实验中还需测定的数据是__________________。
(2)若用空气代替O2进行实验,对测定结果是否有影响?________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为四种可溶性的盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是![]() 、
、![]() 、Cl、
、Cl、![]() 中的一种。(离子在物质中不重复出现)
中的一种。(离子在物质中不重复出现)
①若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色;
②若向①的四支试管中分别加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出。
根据①②实验事实可推断:
(1)A的化学式为____________,B的化学式为____________。
(2)写出少量盐酸与D反应的离子方程式:____________。
(3)写出C与Ba(OH)2溶液反应的离子方程式:________________________。
(4)C溶液中阴离子的检验方法是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组根据镁与CO2的反应设计实验探究镁与NO2的反应。
甲同学推测产物是MgO和N2;
乙同学推测产物除了MgO和N2外,固体中还可能含有Y。
该小组同学设计了以下装置探究镁与NO2反应的固体产物,并测定其组成。
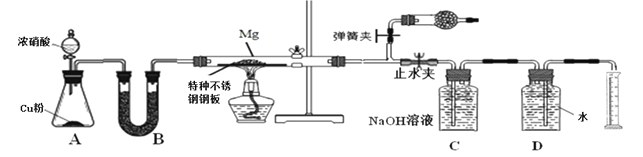
(1)实验开始时,先关闭止水夹后打开弹簧夹,再打开分液漏斗活塞,当硬质玻璃管充满红综色气体后,打开止水夹,关闭弹簧夹,最后点燃酒精灯。这样做的目的是___________________________________________________________
(2)装置B中的试剂可以选用________
A、浓硫酸 B、无水氯化钙 C、五氧化二磷 D、碱石灰
(3)装置C中盛装氢氧化钠溶液的作用是:___________________________________
(4)为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是①气体恢复至室温再读数;②_______________________________;③______________________________。
(5)实验结束后,同学们将固体产物取出与水反应,发现有刺激性气味的气体产生,该气体能使湿润的石蕊试纸变蓝。说明乙组同学推测正确,请写出Y与水反应的化学方程式__________________________________
(6)若初始加入镁粉质量为3.6 g,在足量的NO2中充分反应后 ,收集到N2体积为448mL (标准状况),则产物中MgO的质量是_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com