
| A. | 恒温恒容,充入NO2气体,其转化率增大 | |
| B. | 加压,平衡向逆反应方向移动,混合气体颜色变深 | |
| C. | 若平衡常数增大,则可能是升高了温度或减小了体系的压强 | |
| D. | 当2v正(NO)=v逆(O2)时,反应达到化学平衡状态 |
分析 A、利用等效平衡分析,假设将充入的NO2气体放在另一个容器中建立与原平衡为等效平衡的体系,再将该体系加入到原平衡体系中,容器体积不变是,相当于加压,平衡逆向移动;
B、容器体积减小,平衡向体积减小的方向移动,混合气体的颜色与NO2的浓度成比例,据此判断;
C、根据影响平衡常数的因素判断,平衡常数只随温度变化;
D、化学反应速率之比等于化学方程式计量数之比为正反应速率之比.
解答 解:A、假设将充入的NO2气体放在另一个容器中建立与原平衡为等效平衡的体系,再将该体系加入到原平衡体系中,容器体积不变是,相当于加压,平衡逆向移动,NO2气体的转化率减小,故A错误;
B、因为该反应是体积增大的反应,容器体积减小,平衡逆向移动,NO2的浓度增大,体积减小,所有物质的浓度也都会增大,所以混合气体的颜色会加深,故B正确;
C、平衡常数只受温度影响,与压强无关,故C错误;
D、当v正(NO)═2v逆(O2),反应达到化学平衡,当2v正(NO)=v逆(O2)时不能说明反应达到平衡状态,故D错误;
故选B.
点评 本题主要考查了影响化学平衡移动的因素、等效平衡的思想、影响平衡常数的因素及平衡状态的判断等知识点,中等难度,解题时注意化学原理知识的灵活运用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
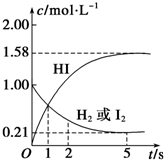 某温度时,向某V L的密闭容器中充入3molH2(g)和3mol I2(g),发生反应:
某温度时,向某V L的密闭容器中充入3molH2(g)和3mol I2(g),发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | NaOH起始读数 | NaOH终点读数 |
| 第一次 | 0.10mL | 18.40mL |
| 第二次 | 3.00mL | 21.10mL |
| 第三次 | 0.20mL | 20.40mL |
| 第四次 | 0.00mL | 18.20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度( oC) | 15.0 | 25.0 | 30.0 | 35.0 |
| K/(×10-8 mol3•L-3) | 0.205 | 1.64 | 4.68 | 10.8 |
| A. | 若Z的体积分数不再随时间变化时表示反应达平衡状态 | |
| B. | 35 oC时,达平衡时,X分解了 0.03 mol | |
| C. | 该反应在高温下可能自发 | |
| D. | 若在恒温下,压缩容器体积,再次达平衡后,n(X)比原平衡大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使 SO3 的浓度增大 | B. | 使平衡向正反应方向移动 | ||
| C. | 使平衡常数 K 增大 | D. | 使正反应速率大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
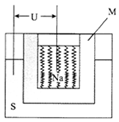 如图是一种钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,其作用是导电和隔膜,该电池反应为2Na+xS=Na2Sx.该电池正极的电极反应式为xS+2e-=Sx2-.
如图是一种钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,其作用是导电和隔膜,该电池反应为2Na+xS=Na2Sx.该电池正极的电极反应式为xS+2e-=Sx2-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在测定中和热的实验中,为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触 | |
| B. | 酸碱中和滴定实验中,锥形瓶要用待装液预先润洗 | |
| C. | 在测定中和热的实验中,用0.5mol•L-1NaOH溶液分别与0.5 mol•L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同 | |
| D. | 测溶液PH值时,PH试纸不能润湿 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8 g | B. | 11.2 g | C. | 5.6 g | D. | 8.4 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com