
【题目】某化学兴趣小组在实验室中进行化学实验按右图甲,连接好线路发现灯泡不亮,按右图乙连接好线路发现灯泡亮,下列结论一定正确的是( )
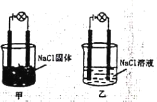
A.NaCl固体是非电解质而NaCl溶液是电解质
B.在通电的条件下,NaCl在水中电离出大量的离子而导电
C.相同条件下,向乙的NaCl溶液中逐滴滴加硝酸银溶液,溶液导电性先减弱后增强
D.甲的NaCl固体中无自由移动的阴阳离子,因此不能导电
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,不能表明反应: 2NO2(g)![]() 2NO(g)+O2(g) 已达平衡状态的是
2NO(g)+O2(g) 已达平衡状态的是
A. 容器中颜色不再改变 B. 混合气平均相对分子质量不再改变
C. 混合气密度不再改变 D. 单位时间内生成n mol O2的同时生成2n mol NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)
A. 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-="==" Cl-+ ClO-+ H2O
B. 该消毒液的pH约为12:ClO-+ H2O![]() HClO+ OH-
HClO+ OH-
C. 该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2↑+H2O
D. 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+CH3COO—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法错误的是( )
A.常温常压下,1mol甲烷分子中所含质子数为10NA
B.2mol/L的NaCl溶液中钠离数目为2NA
C.常温下,46gNO2和N2O4的混合气体中含有的氮原子数目为NA
D.若120g石墨能写a个字,则平均每个字的含有10NA/a个碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钾(![]() )能促使作物或难于萌发的种子发育。设计如下实验制备叠氮化钾并测定其纯度:
)能促使作物或难于萌发的种子发育。设计如下实验制备叠氮化钾并测定其纯度:
I.制备
步骤1:制备亚硝酸丁酯(![]() )
)
![]()
反应装置如图1(夹持装置略去),向烧杯中依次加入稀硫酸、丁醇、亚硝酸钠溶液,待反应完全后,分离出上层油状物,用![]() 和
和![]() 的混合溶液洗涤三次,经干燥后备用。
的混合溶液洗涤三次,经干燥后备用。
步骤2:制备叠氮化钾
![]()
反应装置如图2(夹持及加热装置路去),向仪器A中加入![]() 乙醇溶液、
乙醇溶液、![]() 的联氨(
的联氨(![]() )、亚硝酸丁酯,蒸汽浴加热,反应完全后,叠氮化钾即沉淀出来,冰浴冷却,过滤,先用无水乙醇洗涤,再用无水乙醚洗涤,在空气中于
)、亚硝酸丁酯,蒸汽浴加热,反应完全后,叠氮化钾即沉淀出来,冰浴冷却,过滤,先用无水乙醇洗涤,再用无水乙醚洗涤,在空气中于![]() 干燥。
干燥。


相关物质性质如下:
物质 | 颜色、状态 | 沸点(℃) | 溶解性 |
| 无色晶体 | 受热易分解 | 易溶于水,微溶于乙醇,不溶于乙醚 |
| 无色液休 | 118 | 微溶于水,与乙醇、乙醚混溶 |
| 无色或淡黄色油状液体 | 78 | 不溶于水,与乙醇、乙醚混溶 |
| 无色油状液体 | 118 | 与水、乙醇混溶,不溶于乙醚 |
请回答:
(1)仪器A的名称为_____________.
(2)步骤1中分离出亚硝酸丁酯的操作名称为_____________;步骤1中用NaCl和NaHCO3的混合溶液洗涤的目的是__________________________.
(3)步骤2中冰浴冷却的目的是__________________________;步骤2中干燥产品的温度控制在55~60℃,原因是__________________________
(4)如需提高产品的纯度,可在_____________(填编号)中进行重结晶。
A.无水乙醇 B.无水乙醚 C.水 D.乙醇的水溶液
Ⅱ.分光光度法测定产品的纯度
原理:![]() 与
与![]() 反应非常灵敏,生成红色络合物,在一定波长下测量红色溶液的吸光度,利用“
反应非常灵敏,生成红色络合物,在一定波长下测量红色溶液的吸光度,利用“![]() 吸光度”曲线确定样品溶液中的
吸光度”曲线确定样品溶液中的![]() 。测定步骤如下:
。测定步骤如下:
①用![]() 品体配制
品体配制![]() 标准溶液;
标准溶液;
②配制一组相同体积(![]() )不同浓度的
)不同浓度的![]() 标准溶液,分别加入
标准溶液,分别加入![]() (足量)
(足量)![]() 标准溶液,摇匀,测量吸光度,绘制标准溶液的
标准溶液,摇匀,测量吸光度,绘制标准溶液的![]() 与吸光度的关系曲线,如图;
与吸光度的关系曲线,如图;
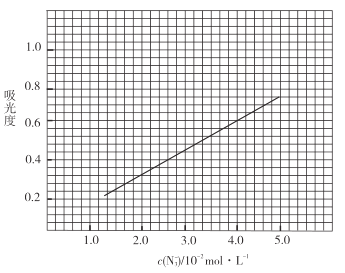
③产品测定:称取0.360g产品,配成![]() 溶液,取出
溶液,取出![]() 于标准管中,加入
于标准管中,加入![]() (足量)
(足量)![]() 标准溶液,摇匀,测得吸光度为0.6。
标准溶液,摇匀,测得吸光度为0.6。
(5)实验室用![]() 晶体配制
晶体配制![]() 标准溶液的方法为_________________.
标准溶液的方法为_________________.
(6)产品的纯度为_________________;若③中加入的![]() 标准溶液不足以将产品完全反应,则测得的产品纯度________________(填“偏高”“偏低”或“无影响”)。
标准溶液不足以将产品完全反应,则测得的产品纯度________________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知常温常压下:
①CH3OH(l)+O2(g)═CO(g)+2H2O(g) △H=-359.8kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-556.0kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0kJ·mol-1
写出体现甲醇燃烧热的热化学方程式为________________________________。
(2)某温度时,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。
CH3OH(g)。
①经过5 min后,反应达到平衡,此时转移电子6 mol。该反应的平衡常数为________。v(H2)=________ mol/(L·min)。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时v(正)________v(逆)(填“>”“<”或“=”)。
②在其他条件不变的情况下,再增加2 mol CO与5 mol H2,达到新平衡时,CO的转化率________(填“增大”“减小”或“不变”)。
③下列不能说明该反应已达到平衡状态的是________。
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变 c.v逆(CO)=2v正(H2) d.混合气体的密度不再发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物A是一种基本化工原料,可以从煤和石油中得到。A、B、C、D、E的转化关系如图所示:回答下列问题:

⑴A的化学名称是______;与A互为同分异构体的芳香化合物还有 _____种,其中核磁共振氢谱图上显示有5个峰,且峰面积之比为1:2:2:2:3的物质的结构简式为:________________。
⑵A→B的反应类型是_______。
⑶A→E的化学方程式为____________________。
⑷A与酸性KMnO4溶液反应可得到D,写出D的结构简式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g)ΔH=-226kJ/mol
O2(g)ΔH=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A. CO的燃烧热为283 kJ
B. 如图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是地壳中含量最多的金属元素,它性能稳定,供应充足,铝—空气电池具有能量密度高、工作原理简单、成本低、无污染等优点。铝—空气电池工作原理示意图如图:
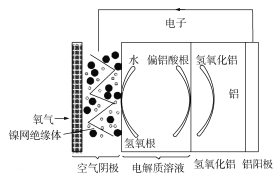
下列说法错误的是
A. 若是碱性电解质溶液中,则电池反应的离子方程式为:4Al+3O2+6H2O+4OH=4Al(OH)4-
B. 若是中性电解质溶液中,则电池反应的方程式为:4Al+3O2+6H2O=4Al(OH)3
C. 如果铝电极纯度不高,在碱性电解质溶液中会产生氢气
D. 若用该电池电解氯化钠溶液(石墨作电极),当负极减少5.4g时,阳极产生6.72L气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com