
| A. | “碘盐”宜密封保存 | |
| B. | “碘盐”就是“I2+NaCl” | |
| C. | 使用“碘盐”时不宜高温煎炒 | |
| D. | 食用加碘盐,以确保人体对碘的摄入量 |
科目:高中化学 来源: 题型:选择题
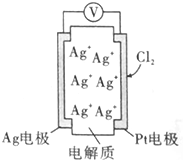 原电池的应用极为广泛.利用如下图所示原电池可测量空气中Cl2的含量,其中电解质是Ag+可以自由移动的固体物质,下列分析正确的是( )
原电池的应用极为广泛.利用如下图所示原电池可测量空气中Cl2的含量,其中电解质是Ag+可以自由移动的固体物质,下列分析正确的是( )| A. | 电流经外电路从Ag流向Pt电极 | |
| B. | 电池工作时,电解质中Ag+数目增多 | |
| C. | 正极反应:Cl2+2e-=2Cl- | |
| D. | 空气中c(Cl2)越大,Ag极消耗速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 | B. | 0.2 | C. | 0.3 | D. | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释( ) |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C═O是极性键 |
| C | H2O的稳定性大于H2S | H2O分子间有氢键 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
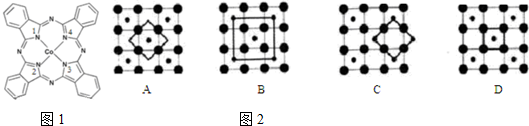
 ),在该晶体中与一个钴原子等距离且最近的钴原子有12个;筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如2所示,小球表示Co原子,大球表示O原子).下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是D.
),在该晶体中与一个钴原子等距离且最近的钴原子有12个;筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如2所示,小球表示Co原子,大球表示O原子).下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是D.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
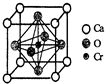 重铬酸钾(K2Cr2O7)是一种重要的氧化剂,可以检验司机是否酒后驾驶.Cr2O72-+3C2H5OH+16H+=41Cr(H2O)6]3++3CH3COOH
重铬酸钾(K2Cr2O7)是一种重要的氧化剂,可以检验司机是否酒后驾驶.Cr2O72-+3C2H5OH+16H+=41Cr(H2O)6]3++3CH3COOH查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24 L CH4气体中含有的电子数为NA | |
| B. | 25℃时,1.0 L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 0.1NA个氯气分子溶于水形成1 L溶液,所得溶液中c(Cl-)=0.1 mol/L | |
| D. | 1 mol CH3COONa和少量CH3COOH溶于水形成的中性溶液中,CH3COO-数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积之比是2:3 | B. | 原子数之比是3:2 | ||
| C. | 质子数之别是1:1 | D. | 物质的量之比是1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com