
你认为下列数据可信的是 ( )
A. 某雨水的pH为5.6
B.某澄清石灰水的浓度是2.0 mol/L
C.某胶体粒子的直径是160 nm
D.某常见气体的密度为1.8 g/cm3
A
【解析】
试题分析:A、pH值小于5.6的雨叫酸雨,正常的雨水都为中性或略小于7,微偏酸,某雨水的pH为5.6,可能是形成的酸雨,故A正确;B、氢氧化钙属于微溶物质,溶解度介于0.01g~1g之间,100g水中溶解氢氧化钙的物质的量小于1g÷40g/mol=0.025mol,溶液体积约等于水的体积100mL,故氢氧化钙的物质的量浓度小于0.025mol÷0.1L=0.25mol/L,故B错误;C、胶体微粒直径在1nm-100nm间,粒子的直径是160nm形成的分散系为浊液,故C错误;D、通常条件下,水的密度约是1g/mL,气体的密度应小于水的密度,故D错误;故选A。
考点:考查溶液浓度有关计算、对微观粒子大小的理解等


科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:填空题
[物质结构与性质](15分)
下表为长式周期表的一部分,其中的序号代表对应的元素。
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ② |
|
|
|
|
|
|
|
|
|
|
| ③ | ④ | ⑤ | ⑥ |
|
| ⑦ |
|
|
|
|
|
|
|
|
|
|
|
|
|
| ⑧ |
|
|
|
|
|
| ⑨ |
|
|
|
| ⑩ |
|
|
|
|
|
|
|
(1)写出上表中元素⑨原子的外围电子排布式__________。
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为__________杂化;元素⑦与⑧形成的化合物的晶体类型是__________。
(3)元素④的第一电离能__________元素⑤(填写“>”“=”或“<”)的第一电离能;元素④与元素①形成的最简单的X分子的空间构型为__________。请写出与元素④的单质互为等电子体分子、离子的化学式__________(各写一种)。
(4)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是_______。
(5)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为__________。
(6)将过量的X通入含有元素⑩的蓝色硫酸盐溶液中,反应的离子方程式为__________;元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则一个晶胞中所包含的氧原子数目为__________。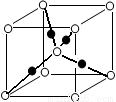
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
常温下,甲、乙、丙、丁四种气态烃的分子中所含电子数分别为10、14、16、18,下列关于这四种气态烃的推断正确的是( )
A.四种气态烃中至少有两种互为同分异构体 B.可以用酸性高锰酸钾溶液鉴别甲和丁
C.丙分子中所有原子均在同一平面上 D.乙和丁属于同系物
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列说法中不正确的是 ( )
A.向滴有酚酞的水中加入过量Na2O2粉末并振荡,溶液由无色变红又变无色
B.向包有Na2O2粉末的脱脂棉上滴加几滴水,脱脂棉剧烈燃烧起来,说明Na2O2与H2O反应是一个放热反应且有氧气生成
C.Na2O2与H2O反应是一个氧化还原反应,Na2O2既是氧化剂,又是还原剂
D.Na2O2与H2O反应是一个置换反应,有单质O2产生
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
MnO2的一些性质或用途如图,下列说法正确的是 ( )
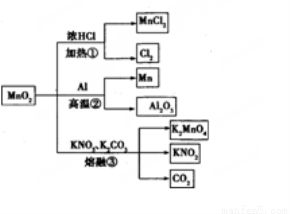
A.①、②、③三个反应中MnO2均作氧化剂
B.足量MnO2与2 L 10 mol/LHCl共热,可生成5 mol C12
C.反应②若生成1 mol Al2O3,则反应过程中转移12 mol电子
D.反应③中K2CO3和KNO3的化学计量数均为1
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:填空题
(10分) Ⅰ研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ?H < 0 (I)
NaNO3(s)+ClNO(g) K1 ?H < 0 (I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ?H < 0 (II)
2ClNO(g) K2 ?H < 0 (II)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol?L-1?min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”。若要使K2减小,可采用的措施是 。
(3)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x= 。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列实验操作完全正确的是
编号 | 实验 | 操作 |
A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 |
C | 为确证NaHCO3固体中是否含Na2CO3 | 取少量待检固体溶于水中,滴加少量BaC12溶液,观察是否有白色沉淀生成 |
D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期中考试化学试卷(解析版) 题型:选择题
已知:
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+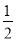 O2(g) ΔH=-266 kJ·mol-1
O2(g) ΔH=-266 kJ·mol-1
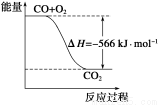
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为283 kJ
B.下图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-532kJ·mol-1
D.CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com