
(10分) Ⅰ研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ?H < 0 (I)
NaNO3(s)+ClNO(g) K1 ?H < 0 (I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ?H < 0 (II)
2ClNO(g) K2 ?H < 0 (II)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol?L-1?min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”。若要使K2减小,可采用的措施是 。
(3)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x= 。
(1)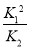 (2)0.025;75%;>;不变;升高温度 (4)4:1 0.05
(2)0.025;75%;>;不变;升高温度 (4)4:1 0.05
【解析】
试题分析:(1)2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g),△H1<0 (Ⅰ),平衡常数K1=
NaNO3(s)+ClNO(g),△H1<0 (Ⅰ),平衡常数K1=
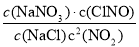 ,2NO(g)+Cl2(g)
,2NO(g)+Cl2(g) 2ClNO(g),△H2<0 (Ⅱ),平衡常数K2 =
2ClNO(g),△H2<0 (Ⅱ),平衡常数K2 =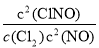 ,
,
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=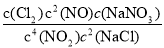 ,计算得到K=
,计算得到K=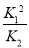 。
。
(2)在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡,测得10min内v(ClNO)=7.5×10-3mol?L-1?min-1,物质的量为7.5×10-3mol?L-1?min-1×10min×2L=0.15mol,依据平衡三段式列式计算;
2NO(g)+Cl2(g) 2ClNO(g)
2ClNO(g)
起始量(mol) 0.2 0.1 0
变化量(mol) 0.15 0.075 0.15
平衡量(mol) 0.05 0.025 0.15
则平衡后n(Cl2)=0.025mol
NO的转化率α1=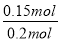 ×100%=75%
×100%=75%
其他条件保持不变,反应(Ⅱ)在恒压条件下进行,随反应进行,气体体积减小,为保持恒压所以容器体积减小,压强增大,平衡正向进行,平衡时NO的转化率α2 增大;平衡常数随温度变化,不随浓度、压强变化,若要使K2减小,平衡逆向进行,反应是放热反应,依据平衡移动原理应升高温度,平衡逆向进行。
(3)①t℃时,反应达到平衡时根据平衡常数表达式K=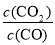 =0.25可知,平衡时n(CO):n(CO2)=1:0.25=4:1。
=0.25可知,平衡时n(CO):n(CO2)=1:0.25=4:1。
② FeO(s)+CO(g) Fe(s)+CO2(g)
Fe(s)+CO2(g)
起始浓度(mol/L) x 0
变化浓度(mol/L) 0.01 0.01
平衡浓度(mol/L) x-0.01 0.01
所以0.01÷(x-0.01)=0.25
解得x=0.05
考点:考查化学平衡常数的计算,影响化学平衡的因素分析应用等


科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列有关说法正确的是
①如果某化合物只含共价键,则其一定是共价化合物
②有阴离子存在的物质中一定存在阳离子
③碳、氮形成的氢化物常温下都是气态
④非金属单质在反应中都只能作氧化剂,具有强氧化性
⑤金属氧化物不一定是碱性氧化物
⑥稀有气体不活泼是因为它们原子最外层都达到8e-稳定结构
A.①②⑤ B.②③④ C.①②⑥ D.②③⑤
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列关于有机物的描述中正确的是( )
A.葡萄糖和果糖互为同分异构体,淀粉和纤维素也互为同分异构体
B.利用蛋白质的颜色反应可以鉴别所有的蛋白质
C.多糖、蛋白质、脂肪和聚丙烯等都属于高分子化合物
D.食醋中的主要成分为乙酸,普通食醋中含有3%- 5%的乙酸
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列说法中正确的是 ( )
A.一定条件下向1 L容器内通入46 g NO2,则NO2的物质的量浓度一定为1 mol/L
B.标准状况下,22.4L的己烷中有20×6.02 × 1023个原子
C.1 mol氯气溶于水转移6.02× 1023个e—
D.0.1 mol CH5+含6.02 × lO23个e一
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
你认为下列数据可信的是 ( )
A. 某雨水的pH为5.6
B.某澄清石灰水的浓度是2.0 mol/L
C.某胶体粒子的直径是160 nm
D.某常见气体的密度为1.8 g/cm3
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
汽车尾气中的有毒气体NO和CO,在一定条件下可发生反应生成N2和CO2。下列关于此反应的说法中,正确的是
A.减小压强能增大反应速率 B.增大压强能减小反应速率
C.使用适当的催化剂能增大反应速率 D.升高温度对反应速率无影响
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
已知反应A+B=C+D的能量变化如右图所示,下列说法正确的是
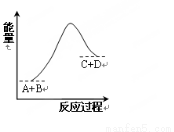
A.该反应为放热反应
B.该反应为吸热反应
C.反应物的总能量高于生成物的总能量
D.该反应只有在加热条件下才能进行
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
在元素周期表中金属与非金属的分界处,可以找到
A.合金B.半导体材料C.催化剂D.农药
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期中考试化学试卷(解析版) 题型:选择题
A、B、C、D、E、F为短周期六种元素,原子序数依次增大,其中A与E同主族且能形成离子化合物EA,B与F同主族,E与F同周期。D的核电荷数是B的最外层电子数2倍,单质F是一种重要的半导体材料。则下列推断中不正确的是
A.由A、C、D三种元素组成的化合物可以是离子化合物
B.F与D形成的化合物熔点高,可以与某种酸反应
C.原子半径由大到小的顺序是:E>F>C>D
D.五种元素中最高价氧化物对应的水化物酸性最强的是D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com