
【题目】一种酸性“二甲醚![]() 直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示。下列有关该电池的说法不正确的是( )
直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示。下列有关该电池的说法不正确的是( )
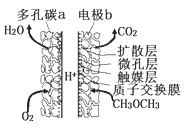
A.多孔碳a能增大气固接触面积,提高反应速率,该电极为正极
B.电极b上发生的反应为: ![]()
C.电子由b电极向a电极迁移
D.二甲醚(![]() )和乙醇(
)和乙醇(![]() )互为同分异构体关系
)互为同分异构体关系
科目:高中化学 来源: 题型:
【题目】下列实验合理的是
A.用![]() 悬浊液不能鉴别乙醇、乙醛、乙酸
悬浊液不能鉴别乙醇、乙醛、乙酸
B.焰色反应后,要用稀硫酸洗涤铂丝并在火焰上燃烧至无色
C.可用O2除去CO2中混有的CO
D.将溴水中的溴提取出来的方法是用CCl4少量多次进行萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是利用二氧化硅制备硅及其化合物的流程,下列说法正确的是
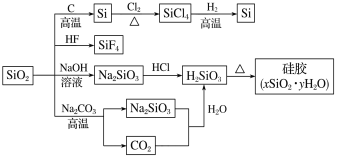
A.SiO2属于两性氧化物B.酸性:H2SiO3>H2CO3
C.硅胶吸水后可重复再生D.图中所示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组制备氯气并对产生氯气的条件进行探究。
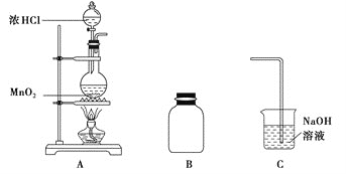
(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的___________(填“氧化性”或“还原性”)。
(2)A中产生的气体不纯,含有的杂质可能是___________。
(3)B用于收集Cl2,请完善装置B并用箭头标明进出气体方向_____________。
(4)C用于吸收多余的Cl2,C中发生反应的离子方程式是____________________________________________________________。
(5)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行如下探究。
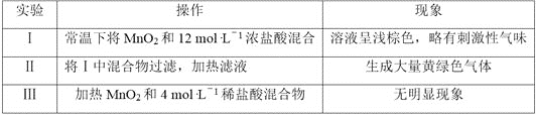
①已知MnO2呈弱碱性。 Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是___________________________________________________。
②Ⅱ中发生了分解反应,反应的化学方程式是__________________________________。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:

将实验Ⅲ、Ⅳ作对比,得出的结论是____________________________;
将ⅰ、ⅱ作对比,得出的结论是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是
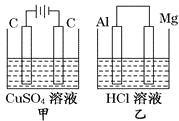
A. 溶液的质量变化:甲减小,乙增大
B. 溶液pH变化:甲减小,乙增大
C. 相同条件下产生气体的体积:V甲=V乙
D. 电极反应式:甲中阴极:Cu2++2e-==Cu,乙中负极:Mg-2e-==Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示示意图,下列说法不正确的是( )
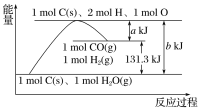
A.反应C(s)+H2O(g)=CO(g)+H2(g),能量增加(b-a)kJ·mol-1
B.该反应过程反应物断键吸收的能量大于生成物成键放出的能量
C.1molC(s)和1molH2O(l)反应生成1molCO(g)和1molH2(g)吸收的热量为131.3kJ
D.1molC(s)、2molH、1molO转变成1molCO(g)和1molH2(g)放出的热量为akJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:酸式乙二酸钠与浓硫酸共热时反应为![]() 。利用该反应所产生的气体(X)用有关仪器装置进行实验:
。利用该反应所产生的气体(X)用有关仪器装置进行实验:

下列说法不正确的是( )
A.对I装置,活塞![]() 关闭,打开活塞
关闭,打开活塞![]() ,在导管D处能得到纯净而干燥的CO
,在导管D处能得到纯净而干燥的CO
B.当A选项反应完成后,再关闭活塞![]() ,打开活塞
,打开活塞![]() ,在导管D处得到纯净而干燥的
,在导管D处得到纯净而干燥的![]()
C.利用装置I中D处所得纯净CO气体,通过实验装置II能够说明CO具有还原性
D.实验装置III与实验装置II相比较,能减少CO污染,能顺利完成氧化铁还原实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。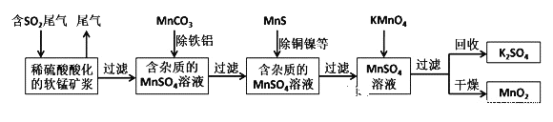
请回答下列问题:
(1)上述流程中多次涉及到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、漏斗以及___。
(2)上述流程脱硫实现了___(选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(3)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是调节溶液的pH,消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀,若25℃时,Ksp[Fe(OH)3]=8.0×10-38,lg2=0.3,要使溶液中的Fe3+完全沉淀,至少要把溶液pH调至___。
(4)已知Ksp(CuS)=8.4×10-45,Ksp(NiS)=1.4×10-24;在除铜镍的过程中,当Ni2+恰好完全沉淀(此时溶液中c(Ni2+)=1.0×10-5mol·L-1),溶液中c(Cu2+)=___mol·L-1。
(5)已知:25℃、101kpa时,Mn(s)+O2(g)=MnO2(s) △H=-520kJ·mol-1
S(s)+O2(g)=SO2(g) △H=-297kJ·mol-1
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是___。
(6)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极,请写出阳极的电极反应式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石等自然界存在的碳酸盐类铜矿的化学组成为xCuCO3·yCu(OH)2(x、y为正整数,且x≤3,y≤2)。
(1)现有两份等量的某碳酸盐类制矿样品,一份加足量盐酸,产生3.36L标准状况下的CO2气体,另一份加热完全分解得到20gCuO,则该碳盐类铜矿的化学组成中x:y=____。
(2)设某碳酸盐类铜矿样品质量为ag,含铜质量为bg,加酸完全分解得到标准状况下CO2气体VL,则a、b、V的代数关系式是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com