
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。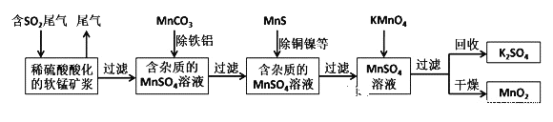
请回答下列问题:
(1)上述流程中多次涉及到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、漏斗以及___。
(2)上述流程脱硫实现了___(选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(3)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是调节溶液的pH,消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀,若25℃时,Ksp[Fe(OH)3]=8.0×10-38,lg2=0.3,要使溶液中的Fe3+完全沉淀,至少要把溶液pH调至___。
(4)已知Ksp(CuS)=8.4×10-45,Ksp(NiS)=1.4×10-24;在除铜镍的过程中,当Ni2+恰好完全沉淀(此时溶液中c(Ni2+)=1.0×10-5mol·L-1),溶液中c(Cu2+)=___mol·L-1。
(5)已知:25℃、101kpa时,Mn(s)+O2(g)=MnO2(s) △H=-520kJ·mol-1
S(s)+O2(g)=SO2(g) △H=-297kJ·mol-1
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是___。
(6)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极,请写出阳极的电极反应式___。
【答案】烧杯 AC 3.3 6.0×10-26mol·L-1 MnO2(s)+SO2(g)=MnSO4(s) △H=-248kJ·mol-1 MnO42--e-=MnO4-
【解析】
由流程可知,二氧化硫能与二氧化锰反应生成硫酸锰,用MnCO3调节溶液pH,使溶液中Al3+和Fe3+转化为沉淀,过滤除去,MnS将铜、镍离子转化为硫化铜、硫化镍沉淀,过滤分离,滤液中加入高锰酸钾与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰。
(1)根据过滤装置图 ,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、漏斗以及烧杯;
,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、漏斗以及烧杯;
(2)流程脱硫实现了废弃物的综合利用、酸雨的减少,与白色污染无关,故选AC;
(3)Fe3+完全水解生成氢氧化铁沉淀时,Fe3+的浓度为1×10-5mol/L,设Fe3+完全水解生成氢氧化铁沉淀时,氢氧根离子的浓度是xmol/L,则1×10-5mol/L×x3=8.0×10-38,x=2×10-11,c(H+)=5×10-4,所以pH=3.3;
(4)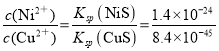 ,所以c(Ni2+)=1.0×10-5mol·L-1时,c(Cu2+)=6.0×10-26mol·L-1;
,所以c(Ni2+)=1.0×10-5mol·L-1时,c(Cu2+)=6.0×10-26mol·L-1;
(5)①Mn(s)+O2(g)=MnO2(s) △H=-520kJ·mol-1
②S(s)+O2(g)=SO2(g) △H=-297kJ·mol-1
③Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ·mol-1
根据盖斯定律,③-①-②得MnO2(s)+SO2(g)=MnSO4(s) △H=-248kJ·mol-1;
(6)K2MnO4→KMnO4锰元素化合价由+6升高为+7,反应氧化反应,阳极的电极反应式是MnO42--e-=MnO4-。


科目:高中化学 来源: 题型:
【题目】高温下硫酸亚铁分解反应为2FeSO4![]() Fe2O3+SO2↑+SO3↑,下列说法不正确的是
Fe2O3+SO2↑+SO3↑,下列说法不正确的是
A.将产生的气体,通入紫色石蕊试液后溶液只变红不褪色
B.将反应后残留固体物质用盐酸溶解,再加入KMnO4溶液后褪色,说明硫酸亚铁固体分解完全
C.将少量产生的气体,分别通入含有NaOH的BaCl2溶液和含有氨水的BaCl2溶液中均产生白色沉淀,且沉淀成分相同
D.在实际实验操作过程将产生的气体通入品红溶液后溶液颜色先加深后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种酸性“二甲醚![]() 直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示。下列有关该电池的说法不正确的是( )
直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示。下列有关该电池的说法不正确的是( )
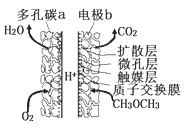
A.多孔碳a能增大气固接触面积,提高反应速率,该电极为正极
B.电极b上发生的反应为: ![]()
C.电子由b电极向a电极迁移
D.二甲醚(![]() )和乙醇(
)和乙醇(![]() )互为同分异构体关系
)互为同分异构体关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的资源,如图为海水资源利用的部分过程。
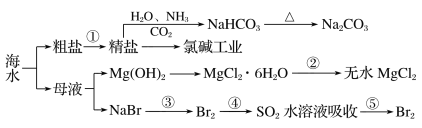
下列有关说法正确的是( )
A.用澄清石灰水可鉴别NaHCO3和Na2CO3
B.第③步和第⑤步均发生了氧化还原反应
C.在第③④⑤步中溴元素均被氧化
D.工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷是液化石油气主要成分之一,是一种优良的燃料。试回答下列问题:
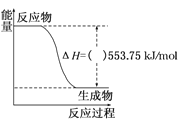
(1)如图是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,(图中的括号内填入“+”或“﹣”)_____。写出表示丙烷燃烧热的热化学方程式:_________________________
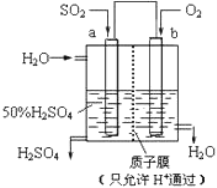
(2)科研人员设想用如图所示装置生产硫酸。
①上述生产硫酸的总反应方程式为_____________,b 是___________ 极(填“正”或“负”),b 电极反应式为______________________________,a 电极发生______________ (填“氧化反应”或“还原反应”)。②生产过程中H+向_____(填 a 或 b)电极区域运动。
(3)将两个铂电极插入氢氧化钾溶液中,向两极分别通入甲烷和氧气,可构成甲烷燃料电池,已知通入甲烷的一极为负极,其电极反应式为:_______________________。电池在放电过程中,溶液的pH值将______________ 。(填“下降”“上升”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是常温下几种常见弱酸的电离平衡常数:
弱酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | K=1.6×10-5 |
H2C2O4 | H2C2O4 HC2O4- | K1=5.9×10-2 K2=6.4×10-5 |
H2CO3 | H2CO3 HCO3- | K1=4.4×10-7 K2=5.6×10-11 |
H2S | H2S HS- | K1=9.1×10-8 K2=1.1×10-15 |
回答下列问题:
(1)某温度下,纯水中的c(H+)=2.0×10-7mol·L-1,若温度不变,滴入稀硫酸使c(H+)=5.0×10-6mol/L,则由水电离出的c(H+)为___mol·L-1。
(2)下列四种离子结合H+能力最强的是___。
A.HCO3- B.C2O42- C.S2- D.CH3COO-
(3)常温下1.0mol·L-1的CH3COOH溶液中的c(H+)=___mol·L-1。
(4)常温下,加水稀释0.1mol·L-1的H2C2O4溶液,下列说法正确的是___。
A.溶液中n(H+)·n(OH-)保持不变
B.溶液中水电离的c(H+)·c(OH-)保持不变
C.溶液中![]() 保持不变
保持不变
D.溶液中c(OH-)增大
(5)将CH3COOH溶液加入少量Na2CO3溶液中,反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2A(s) ![]() B(g)+C(g),在一定条件下的刚性密闭容器中,起始时加入一定量的A,能判断反应达到平衡状态的有( )
B(g)+C(g),在一定条件下的刚性密闭容器中,起始时加入一定量的A,能判断反应达到平衡状态的有( )
①单位时间内生成2molA的同时生成1molB ②v (B): v (C)=1:1 ③密闭容器中混合气体的平均摩尔质量不变 ④混合气体的密度不再改变 ⑤B的体积分数不再改变 ⑥混合气体的压强不再改变
A. 3个 B. 4个 C. 5个 D. 6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应中,反应混合物A、B、C的物质的量浓度(c)与时间(t)关系如下表所示:
初始 | 2 min | 4 min | 6 min | |
c (A)(mol/L) | 1.45 | 1.28 | 1.00 | 1.00 |
c (B)(mol/L) | 0.38 | 0.72 | 1.28 | 1.28 |
c (C)(mol/L) | 0.095 | 0.18 | 0.32 | 0.32 |
下列说法正确的是( )
A.该反应的化学方程式为A = 2B+C
B.4 min末A的转化率约为31%
C.4~6min时,反应停止了
D.正反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种主族元素X、Y、Z、M和N在周期表中的位置如图所示。下列说法正确的是

A. M的原子半径比N小
B. Y和Z既可形成Z2Y,也可形成Z2Y2
C. X2M的热稳定性比X2Y强
D. M和N的氧化物的水化物均为强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com