
【题目】下表是常温下几种常见弱酸的电离平衡常数:
弱酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | K=1.6×10-5 |
H2C2O4 | H2C2O4 HC2O4- | K1=5.9×10-2 K2=6.4×10-5 |
H2CO3 | H2CO3 HCO3- | K1=4.4×10-7 K2=5.6×10-11 |
H2S | H2S HS- | K1=9.1×10-8 K2=1.1×10-15 |
回答下列问题:
(1)某温度下,纯水中的c(H+)=2.0×10-7mol·L-1,若温度不变,滴入稀硫酸使c(H+)=5.0×10-6mol/L,则由水电离出的c(H+)为___mol·L-1。
(2)下列四种离子结合H+能力最强的是___。
A.HCO3- B.C2O42- C.S2- D.CH3COO-
(3)常温下1.0mol·L-1的CH3COOH溶液中的c(H+)=___mol·L-1。
(4)常温下,加水稀释0.1mol·L-1的H2C2O4溶液,下列说法正确的是___。
A.溶液中n(H+)·n(OH-)保持不变
B.溶液中水电离的c(H+)·c(OH-)保持不变
C.溶液中![]() 保持不变
保持不变
D.溶液中c(OH-)增大
(5)将CH3COOH溶液加入少量Na2CO3溶液中,反应的离子方程式为___。
【答案】8×10-9 C 4.0×10-3 D 2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O
【解析】
(1)某温度下,纯水中的c(H+)=2.0×10-7mol·L-1,依据计算得到水的离子积常数为4.0×10-14,结合离子积常数计算得到溶液中氢氧根离子浓度,水电离出的氢氧根离子和氢离子浓度相同;
(2)弱酸的电离平衡常数越小,酸根离子结合氢离子的能力越强;
(3)根据常温下CH3COOH的电离平衡常数计算c(H+);
(4)常温下,加水稀释0.1mol·L-1的H2C2O4溶液,电离平衡正向移动,电离平衡常数不变、水的离子积常数不变;
(5)CH3COOH的酸性大于H2CO3,性将CH3COOH溶液加入少量Na2CO3溶液中生成醋酸钠、水、二氧化碳;
(1)某温度下,纯水中的c(H+)=2.0×10-7molL-1,水电离出的离子浓度c(OH-)= c(H+),则c(OH-)= c(H+)=2.0×10-7molL-1。若温度不变,滴入稀盐酸使c(H+)=5.0×10-4molL-1,Kw= c(OH-)×c(H+)=4.0×10-14,c(OH-)=![]() mol/L =8×10-9mol/L;
mol/L =8×10-9mol/L;
(2)CH3COOH的电离平衡常数是1.6×10-5、HS-的电离平衡常数是1.1×10-15、HC2O4-的电离平衡常数是6.4×10-5、H2CO3的电离平衡常数是4.4×10-7,电离平衡常数越小,酸根离子结合氢离子能力越强,结合H+能力最强的是S2-,选C;
(3)设1.0mol·L-1的CH3COOH溶液中的c(H+)=xmol·L-1。CH3COOH![]() CH3COO-+H+,忽略水电离出的H+,则溶液中c(H+)≈c(CH3COO-);弱电解质的电离是微弱的,则c(CH3COOH)=1mol·L-1,则醋酸的电离平衡常数
CH3COO-+H+,忽略水电离出的H+,则溶液中c(H+)≈c(CH3COO-);弱电解质的电离是微弱的,则c(CH3COOH)=1mol·L-1,则醋酸的电离平衡常数 ;可求得x=4.0×10-3mol·L-1;
;可求得x=4.0×10-3mol·L-1;
(4)A.c(OH-)×c(H+)不变,加水稀释体积增大,所以溶液中n(H+)·n(OH-)增大,故A错误;
B.加水稀释0.1mol·L-1的H2C2O4溶液,酸的浓度降低,水的电离程度增大,溶液中的OH-均来自水的电离,c(OH-)增大,水电离出来的OH-和H+相等,则溶液中水电离的c(H+)·c(OH-)增大,故B错误;
C.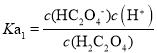 ,加水稀释0.1mol·L-1的H2C2O4溶液,c(H+)减小,溶液中
,加水稀释0.1mol·L-1的H2C2O4溶液,c(H+)减小,溶液中![]() 增大,故C错误;
增大,故C错误;
D.c(OH-)×c(H+)不变,加水稀释0.1mol·L-1的H2C2O4溶液,c(H+)减小,溶液中c(OH-)增大,故D正确;
答案选D;
(5)CH3COOH的酸性大于H2CO3,将CH3COOH溶液加入少量Na2CO3溶液中生成醋酸钠、水、二氧化碳,反应离子方程式是2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】绿原酸是咖啡的热水提取液成分之一,结构简式如图,关于绿原酸判断正确的是( )
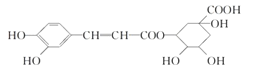
A.1mol 绿原酸与足量 NaHCO3 溶液反应,生成 3molCO2 气体
B.1mol 绿原酸与足量 Na 反应,最多消耗 6molNa
C.1mol 绿原酸与足量 NaOH 溶液反应,最多消耗 3molNaOH
D.绿原酸水解产物均可以与 FeCl3 溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示示意图,下列说法不正确的是( )
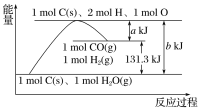
A.反应C(s)+H2O(g)=CO(g)+H2(g),能量增加(b-a)kJ·mol-1
B.该反应过程反应物断键吸收的能量大于生成物成键放出的能量
C.1molC(s)和1molH2O(l)反应生成1molCO(g)和1molH2(g)吸收的热量为131.3kJ
D.1molC(s)、2molH、1molO转变成1molCO(g)和1molH2(g)放出的热量为akJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要有机化工原料。结合以下路线回答:
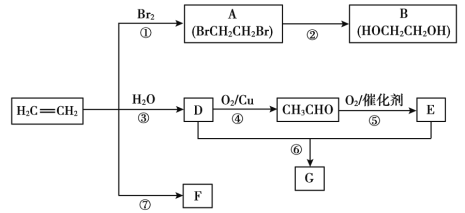
已知:2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
(1)反应①的化学方程式是__。
(2)B的官能团是__。
(3)F是一种高分子,可用于制作食品袋,其结构简式为__。
(4)G是一种油状、有香味的物质,有以下两种制法。
制法一:实验室用D和E反应制取G,某学习小组在实验室制取乙酸乙酯的主要步骤如下:
i.配制2mL浓硫酸、3mLD(含18O)和2mLE的混合溶液。
ii.按如图连接好装置并加入混合液,用小火均匀加热3~5min。
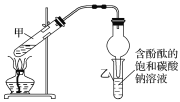
iii.待试管乙收集到一定量产物后停止加热,撤出试管乙用力振荡,然后静置待分层。
iv.分离出乙酸乙酯,洗涤、干燥。
回答问题:
①装置中球形干燥管,除起冷凝作用外,另一重要作用是___。
②步骤②安装好实验装置,加入药品前还应检查__。
③反应中浓硫酸的作用是__;写出能表示18O位置的制取乙酸乙酯的化学方程式:__。
④上述实验中饱和碳酸钠溶液的作用是__(填字母)。
a.中和乙酸并吸收乙醇
b.中和乙酸和乙醇
c.降低乙酸乙酯的溶解度
d.加速酯的生成,提高其产率
⑤步骤③所观察到的现象是__;从试管乙中分离出乙酸乙酯的实验操作名称是___。
制法二:工业上用CH2=CH2和E直接反应获得G。
a.反应类型是__。
b.与制法一相比,制法二的优点是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。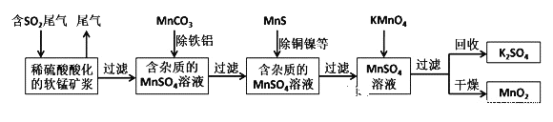
请回答下列问题:
(1)上述流程中多次涉及到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、漏斗以及___。
(2)上述流程脱硫实现了___(选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(3)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是调节溶液的pH,消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀,若25℃时,Ksp[Fe(OH)3]=8.0×10-38,lg2=0.3,要使溶液中的Fe3+完全沉淀,至少要把溶液pH调至___。
(4)已知Ksp(CuS)=8.4×10-45,Ksp(NiS)=1.4×10-24;在除铜镍的过程中,当Ni2+恰好完全沉淀(此时溶液中c(Ni2+)=1.0×10-5mol·L-1),溶液中c(Cu2+)=___mol·L-1。
(5)已知:25℃、101kpa时,Mn(s)+O2(g)=MnO2(s) △H=-520kJ·mol-1
S(s)+O2(g)=SO2(g) △H=-297kJ·mol-1
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是___。
(6)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极,请写出阳极的电极反应式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于净化汽车尾气的反应:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g),已知该反应速率极慢,570K时平衡常数为1×1059。下列说法正确的是
2CO2(g)+N2(g),已知该反应速率极慢,570K时平衡常数为1×1059。下列说法正确的是
A.装有尾气净化装置的汽车排出的气体中一定不再含有NO或CO
B.提高尾气净化效率的常用方法是升高温度
C.提高尾气净化效率的最佳途径是研制高效催化剂
D.570K时该反应正向进行的程度很大,故使用催化剂并无实际意义
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)已知反应8NH3+6NO2=7N2+12H2O,请分析氧化产物和还原产物的质量之比为________。
(2)水体中过量氨氮(以NH3表示)会导致水体富营养化。
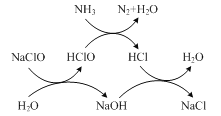
①用次氯酸钠除去氨氮的原理如题图所示。写出该图示的总反应化学方程式:________。
该反应需控制温度,温度过高时氨氮去除率降低的原因是________。
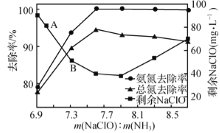
②取一定量的含氨氮废水,改变加入次氯酸钠用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaCIO)m(NH3)的变化情况如图所示。当m( NaCIO):m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3= 7N2+12H2O构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。下列说法正确的是:

A.电流从左侧A电极经过负载后流向右侧B电极
B.当有4.48 L NO2被处理时,转移电子数为0.8NA
C.电极A极反应式为2NH3-6e-= N2+6H+
D.为使电池持续放电,离子交换膜需选用阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组在整理实验室化学试剂时,发现一瓶盛有无色溶液的试剂,标签破损,如图。
某同学根据中学化学知识,对该溶液中的溶质成分进行如下预测和验证,其中错误的是(包括预测物质的化学式、检验需要的试剂、操作、现象及结论)
选项 | 预测物质的化学式 | 检验需要的试剂 | 操作、现象及结论 |
A | Na2SO4 | 稀盐酸、氯化钡溶液 | 取少量该溶液于试管中,滴入稀盐酸,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,则原溶液是Na2SO4溶液 |
B | Na2CO3 | 稀盐酸、澄清的石灰水 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清的石灰水变浑浊,则原溶液一定是Na2CO3溶液 |
C | Na2SO3 | 稀盐酸、澄清的石灰水、品红溶液 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体既能使澄清的石灰水变浑浊,还能使品红溶液褪色,则原溶液是Na2SO3溶液 |
D | Na2SiO3 | 过量稀盐酸 | 取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀不溶解,则原溶液是Na2SiO3溶液 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com