有A、B、C、D四种短同期元素,最高正价依次为+1、+4、+5、+7,其核电荷数按B、C、A、D的顺序增大.已知B、C的次外层电子数为2,D、A的次外层电子数均为8,且A、D原子的电子层数相同.请回答:
(1)写出A、B、C、D的元素符号:A______、B______、C______、D______.
(2)画出A的原子结构示意图:______;
(3)写出AD的电子式:______;
(4)写出A、C的最高价氧化物对应水化物相互反应的化学方程式:______.
【答案】
分析:短周期中最高化合价与最外层电子数,由此可以确定元素所在的族,结合次外层电子数及原子序数的变化判断出元素,根据元素及其化合物性质答题.
解答:解:(1)短周期元素的最高化合价等于族序数,所以A在ⅠA族、B在ⅣA族、C在ⅤA族、D在ⅤⅡA族,又A、D的次外层电子数为8,则A、D均为第三周期元素,A为Na、D为Cl;B、C的次外层电子数为2,在第二周期,所以B为C、C为N.
故答案为:Na、C、N、Cl;
(2)A为Na,核外有三个电子层,电子数分别为2、8、1,原子结构示意图为
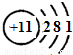
,
故答案为:
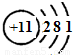
;
(3)AD为氯化钠,是离子化合物,电子式中氯离子应用中括号括起来且右上角标出所带电荷,电子式为
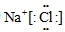
,
故答案为:
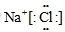
;
(4)A、C的最高价氧化物对应的水化物分别为NaOH、HNO
3,二者反应生产NaNO
3和H
2O,反应的方程式为NaOH+HNO
3═NaNO
3+H
2O,
故答案为:NaOH+HNO
3═NaNO
3+H
2O.
点评:本题主要考查元素推断及元素化合物性质.要灵活应用原子结构与元素性质的关系,正确书写化合物电子式及原子结构示意图.

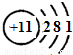 ,
,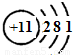 ;
;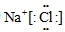 ,
,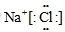 ;
;

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案








