
【题目】25℃时,物质的量浓度均为0.1molL﹣1的几种盐溶液的pH如表:
序号 | ① | ② | ③ | ④ | ⑤ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
(1)写出溶液④中通少量CO2的离子方程式:_________________________.
(2)25℃时,溶液①中,由水电离产生的c(OH﹣)=_____molL﹣1。
(3)下列说法正确的是_____。
A.c(NH4+):①>②
B.物质的量浓度和体积均相等的NaCl和CH3COONH4两种溶液中,离子总数相等
C.等体积的③和⑤形成的混合溶液中:c(HCO3﹣)+c(CO32﹣)=0.1molL﹣1
D.将pH相同的CH3COOH和HX溶液加水稀释相同倍数,HX溶液的pH变化小
(4)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl﹣),则一水合氨的电离平衡常数Kb=____________.(用ab表示)
【答案】 X﹣+CO2+H2O=HCO3﹣+HX 10﹣5 A,D ![]()
【解析】(1)由图表可知,等浓度时NaX溶液pH大于NaHCO3,小于Na2CO3,说明等浓度时水解程度NaHCO3<NaX<Na2CO3。“越弱越水解”,所以酸性HCO3﹣<HX<H2CO3。由“强酸制弱酸”可知,向溶液NaX中通少量CO2生成HX和HCO3﹣,离子方程式为:X﹣+CO2+H2O=HCO3﹣+HX。
故答案为:X﹣+CO2+H2O=HCO3﹣+HX;
(2)25℃时,NH4Cl溶液中,NH4+结合水电离出的OH﹣生成NH3H2O,促进水的电离。溶液pH=5,而H+全部来自于水的电离,所以由水电离产生的c(H+)水=c(OH﹣)水=10-5mol/L。
故答案为:10-5;
(4)A、等浓度的NH4Cl和CH3COONH4溶液,醋酸铵溶液中NH4+水解程度大,则c(NH4+)小,所以c(NH4+):①>②,故A正确;B、NaCl和CH3COONH4+溶液pH=7,则两溶液中c(H+)=c(OH﹣)=10-7mol/L,等浓度等体积的NaCl和CH3COONH4两种溶液中,n(H+)、n(OH﹣)均相等。醋酸根和NH4+均要发生水解,则c(Na+)= c(Cl﹣)>c(NH4+)= c(CH3COO﹣),所以两溶液中离子总数不相等,故B错误;C、等体积的③和⑤形成的混合溶液中存在物料守恒,碳元素守恒:c(H2CO3)+c(HCO3﹣)+c(CO32-)=0.1mol/L ,故C错误;D、CH3COOH酸性大于HX,将pH相同的CH3COOH和HX溶液加水稀释相同倍数,HX溶液的pH变化小,故D正确。
故答案为:A,D;
(5)NH3H2O电离方程式为NH3H2O NH4++OH﹣,则电离常数为Kb=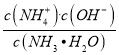 。常温时,将amol NH3溶于水后,再通入bmolHCl,溶液体积为1L,则c(Cl﹣)=bmol/L。根据物料守恒可知c(NH4+)+ c(NH3H2O)=amol/L,又因为c(NH4+)= c(Cl﹣) =bmol/L,所以c(NH3H2O)=(a-b)mol/L。溶液中存在的离子为NH4+、H+、Cl﹣、OH﹣,则有电荷守恒c(NH4+)+ c(H+)=c(Cl﹣)+ c(OH﹣),因为c(NH4+)= c(Cl﹣),所以c(H+)= c(OH﹣),则溶液呈中性,c(H+)= c(OH﹣)=10-7mol/L。将各数据代入平衡常数表达式,可得Kb=
。常温时,将amol NH3溶于水后,再通入bmolHCl,溶液体积为1L,则c(Cl﹣)=bmol/L。根据物料守恒可知c(NH4+)+ c(NH3H2O)=amol/L,又因为c(NH4+)= c(Cl﹣) =bmol/L,所以c(NH3H2O)=(a-b)mol/L。溶液中存在的离子为NH4+、H+、Cl﹣、OH﹣,则有电荷守恒c(NH4+)+ c(H+)=c(Cl﹣)+ c(OH﹣),因为c(NH4+)= c(Cl﹣),所以c(H+)= c(OH﹣),则溶液呈中性,c(H+)= c(OH﹣)=10-7mol/L。将各数据代入平衡常数表达式,可得Kb=![]() 。
。
故答案为: ![]() 。
。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质在一定条件下反应,可以制得较纯净的1,2—二氯乙烷的是( )
A.乙烷与氯气光照反应
B.乙烯与氯化氢气体混合
C.乙烯与氯气加成
D.乙烯通入浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 若2.24L某气体中含有的分子数为0.1NA,则该气体所处的状态一定为标准状况
B. 一定条件下,密闭容器中1.4gN2与0.2molH2充分反应,转移的电子数为0.3NA
C. 0.1mol熔融状态下的NaHSO4中含有的阴离子数为0.2NA
D. 7.4g丁醇中存在的共价键总数为1.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取少量N2常利用的反应是NaNO2+NH4Cl![]() NaCl+N2↑+2H2O,关于该反应的说法正确的是
NaCl+N2↑+2H2O,关于该反应的说法正确的是
A. NaNO2发生氧化反应
B. 生成1 mol N2时转移的电子数为6 mol
C. NH4Cl中的氮元素被还原
D. 被氧化和被还原的元素是同一种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类重要的反应,请按要求完成下列题目。
(1)对反应NH3+O2——NO+H2O(未配平)作分析,并用单线桥法标出电子转移的方向和数目: ___________________________________________________________。该反应中,________是还原剂,________是还原产物,被还原的物质是________。
(2)在一定条件下,反应2NH3+3CuO![]() 3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是______。
3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是______。
①该反应是置换反应
②反应中NH3被氧化为N2
③在反应中体现了金属铜的还原性
④在反应中每生成1 mol H2O转移1 mol电子
(3)在反应2H2S+SO2![]() 3S+2H2O中被氧化的元素与被还原的元素的质量比为 ________。
3S+2H2O中被氧化的元素与被还原的元素的质量比为 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废水中含有的NH4+在一定条件下可被O2氧化,反应过程如下:
①NH4+(aq)+3/2O2(g)=NO2-(aq)+2H+(aq)+H2O(l) △H =-273kL/mol
②NO2-(aq)+l/2O2(g)=NO3-(aq) △H =-73kL/mol
下列叙述不正确的是
A. lmol的NH3和1mol的NH4+都有10×6.02×1023个电子
B. 室温下,0.1mol/LHNO2(aq) pH>l,则NaNO2溶液显碱性
C. NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) △H =-346kL/mol
D. 在上述两次转化过程中,废水的酸性先增大然后逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2可用作制氧剂、漂白剂。
(1)已知:2CrO42ˉ+2H+![]() Cr2O72ˉ+H2O。在碱性溶液中,Na2O2可以把Cr2(SO4)3中的Cr元素氧化成+6价,该反应的离子方程式为___________________________________。
Cr2O72ˉ+H2O。在碱性溶液中,Na2O2可以把Cr2(SO4)3中的Cr元素氧化成+6价,该反应的离子方程式为___________________________________。
(2)某化学兴趣小组同学欲在实验室中制备少量Na2O2。
查阅资料得知,将钠加热至熔化,通入一定量的除去CO2的空气,维持温度在453—473K之间,钠即被氧化为Na2O;进而增加空气流量并迅速提高温度至573—673K,即可制得Na2O2。

①若采用上述仪器装置制备Na2O2,从左到右仪器的连接顺序为(填接口字母,各装置只能用一次)________;装置D的作用为________。
②装置A中生成Na2O2的化学反应方程式为_______________________。
③若实验时准确称取2.3 gNa进行反应,将反应后的固体溶于1L水中,向所得溶液中加入50 mL 0.5 mol/L NH4Al(SO4)2溶液充分反应,请写出加入NH4A1(SO4)2溶液后发生反应的离子方程式________。
(3)小组同学继续对反应后固体的组成进行探究。
a.取一定量反应后固体,加入足量水充分反应,有气体生成;
b.将生成的气体全部转入真空密闭容器中,放电后充分反应,气体体积减少了3 / 5(不考虑O3的生成)。
①反应后固体中一定有的物质为________(填化学式)。
②为进一步确定反应后固体的组成,需对b中剩余气体继续进行猜想与设计,请完成下表。
猜想 | 实验设计 | 现象与结论 |
剩余气体为___________。 | _______________________________。 | 若看到____________ 证明此猜想正确,反之则不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子键和离子化合物的说法正确的是( )
A. 阴、阳离子间通过静电引力形成离子键
B. 阴、阳离子间通过离子键一定能形成离子化合物
C. 离子化合物都能导电,它们都是电解质
D. 只有活泼金属元素和活泼非金属元素化合时,才能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素A和B可形成组成为AB2的离子化合物,则A、B两原子的最外层电子排布分别为( )
A.ns2np2和ns2np4B.ns2和ns2np4C.ns2和ns2np5D.ns1和ns2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com