
短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13。X的原子半径比Y的小,X与W同主族,Z是地壳中含量最高的元素。下列说法正确的是
A.原子半径的大小顺序:r(Y)>r(Z)>r(W)
B.元素Z、W的简单离子的电子层结构不同
C.元素Y的简单气态氢化物的热稳定性比Z的强
D.只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物
D
【解析】
试题分析:根据题意可知这几种元素分别是:X是H;Y是N;Z是O;W是Na。A.同一周期的元素原子序数越大,原子半径越小;不同周期的元素原子核外电子层数越多,原子半径越大。原子半径的大小顺序: r(W) >r(Y)>r(Z),错误;B.元素Z、W的简单离子的电子层结构都是2、8的电子层结构,是相同的,错误;C.由于元素的非金属性O>N,元素的非金属性越强,其相应的氢化物的稳定性就越强,所以元素Y的简单气态氢化物的热稳定性比Z的弱,错误;D.只含X、Y、Z三种元素的化合物,可能是离子化合物如NH4NO3,也可能是共价化合物HNO3,正确。
考点:考查元素的推断、元素的原子结构、性质的知识。


科目:高中化学 来源:2015届浙江省嘉兴市高二暑假作业检测(开学作业检测)化学试卷(解析版) 题型:填空题
(9分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,B元素原子L层上的电子数为K层电子数的2倍;元素D的2价阴离子的核外电子排布与氖原子相同;E与A同主族;A和E这两种元素与D都能形成X2Y、X2Y2型化合物。请回答:
(1)写出元素的符号:C ;E 。
(2)化合物A2D2的电子式为 。
(3)元素B的一种同位素可测定文物年代,这种同位素的符号是 。
(4)B的最高价氧化物的结构式 。
(5)A和C形成的化合物与D单质的反应是重要的工业反应,写出反应方程式 。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
分子式为C10H20O2的有机物A,能在酸性条件下水解生成有机物C和D,且C在一定条件下可转化成D,则A的可能结构有( )
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源:2015届浙江省“温州八校”高三返校联考化学试卷(解析版) 题型:选择题
电导率可用于衡量电解质溶液导电能力的大小,且电导率越大溶液的导电能力越强。室温下 ,用0.l00 mol·L-1的NH3· H2O 滴定10 .00mL 浓度均为0 . 100 mol·L-1HCl和CH3COOH的混合液,电导率曲线如图所示。下列说法正确的是

A.① 溶液中c(H +)为0 . 200 mol·L-1
B.溶液温度高低为① >③ >②
C.③ 点后因离子数目减少使电导率略降低
D.③ 点时溶液中有c ( C1一)>(CH3 COO一)
查看答案和解析>>
科目:高中化学 来源:2015届浙江省“温州八校”高三返校联考化学试卷(解析版) 题型:选择题
某兴趣小组以废弃的易拉罐、漂白粉、氢氧化钠等为原料制造了一种新型环保电池,并进行相关实验,如图所示。电池的总反应方程式为2Al+3ClO-+2OH-===3Cl-+2AlO +H2O。下列说法正确的是
+H2O。下列说法正确的是
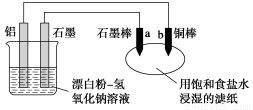
A.电池的负极反应式为:ClO-+H2O+2e-===Cl-+2OH-
B.当有0.1 mol Al完全溶解时,流经电解液的电子数为1.806×1023个
C.往滤纸上滴加酚酞试液,b极附近颜色变红
D.b极附近会生成蓝色固体
查看答案和解析>>
科目:高中化学 来源:2015届浙江省“温州八校”高三返校联考化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列说法正确的是
A.通常状况下,3.36升氯气与2.7克铝充分反应转移的电子数小于0.3NA
B.100g 98%的浓硫酸溶液中含氧原子个数为4NA
C.1mol二氧化硅晶体中含有2NA个硅氧键
D.0.1L 3mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3NA
查看答案和解析>>
科目:高中化学 来源:2015届河南长葛第三实验高中高二下学期第一次考试化学试卷(解析版) 题型:选择题
写出下列反应的化学方程式,并注明反应类型。
(1)由乙烯制备聚乙烯 。
(2)由苯制环己烷 。
(3)用甲苯制TNT 。
(4)溴乙烷与NaOH的乙醇溶液共热 。
查看答案和解析>>
科目:高中化学 来源:2015届河南省高三上学期第一次测试化学试卷(解析版) 题型:填空题
(15分)已知几种离子的还原能力强弱顺序为I->Fe2+>Br-,现有200 mL混合溶液中含FeI2、FeBr2各0.10 mol,向其中逐滴滴入氯水(假定Cl2分子只与溶质离子反应,不考虑其他反应)
(1)若氯水中有0.15 mol Cl2被还原,则所得溶液中含有的阴离子主要是________,剩余Fe2+的物质的量为________。
(2)若原溶液中Br-有一半被氧化,共消耗Cl2的物质的量为________,若最终所得溶液为400 mL,其中主要阳离子及其物质的量浓度为________。
(3)通过对上述反应的分析,试判断Cl2、I2、Fe3+、Br2四种氧化剂的氧化能力由强到弱的顺序是________________________。
(4)上述反应若原溶液中溶质离子全部被氧化后,再滴入足量氯水,则I2全部被Cl2氧化成HIO3(强酸)。试写出此反应的离子方程式:_________________;上述所有反应共消耗Cl2________mol。
查看答案和解析>>
科目:高中化学 来源:2015届河南省偃师市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列有关金属的说法中,正确的是
①纯铁不容易生锈②钠着火用水扑灭
③铝在空气中耐腐蚀,所以铝是不活泼金属④缺钙会引起骨质疏松,缺铁会引起贫血
⑤青铜、不锈钢、硬铝都是合金⑥KSCN溶液可以检验Fe3+
A.①④⑤⑥ B.②③④⑤ C.①③④⑤D.①②⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com