
����Ŀ����֪25��ʱ��Ksp(Ag2S)=6.3��10��50��Ksp(AgCl)=1.5��10��16��ij�о���ѧϰС��̽��AgCl��Ag2S����ת����ԭ��
���� | ���� |
��.��NaCl��AgNO3��Һ��� | ������ɫ���� |
��.�����ù�Һ������м�Na2S��Һ | ������Ϊ��ɫ |
��.�˳���ɫ����������NaCl��Һ | �ڿ����з��ýϳ�ʱ�������Ϊ���ɫ |
(1)���еİ�ɫ������__��
(2)������˵��������ڵ����ӷ���ʽ��__��
(3)�˳�����������ɫ�������Ʋ⺬��AgCl����ŨHNO3�ܽ⣬��������ɫ���壬���������ܽ⣬���˵õ���ҺX�Ͱ�ɫ����Y��
��.��X�еμ�Ba(NO3)2��Һ��������ɫ����
��.��Y�еμ�KI��Һ��������ɫ����
���ɢ��жϣ���ҺX�б������������__��
���ɢ�������ȷ�ϲ���������ɫ��������AgCl����һ�ֳ���__��
(4)��ѧ��ͨ�����¶���ʵ��ȷ���˲���������ɫ����������ԭ����NaCl�����£����������к�ɫ����������
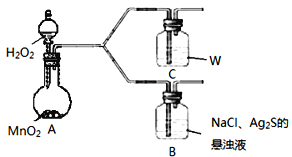
���� | B��һ��ʱ��������ɫ���� |
C��һ��ʱ��������Ա仯 |
��A�����������___��
��C��ʢ�ŵ�����W��__��
�۸�ͬѧ��ΪB�в��������ķ�Ӧ���£��벹����������__
2Ag2S+__+__+2H2O=4AgCl+__+4NaOH
�ܴ��ܽ�ƽ���ƶ��ĽǶȣ�����B��NaCl������__��
���𰸡�AgCl 2AgCl(s)+S2-(aq)=Ag2S(s)+2Cl-(aq) SO42- S O2 Ag2S������Һ 2Ag2S��1O2��4NaCl��2H2O=4AgCl��2S��4NaOH �����ܽ�ƽ��Ag2S(s)![]() 2Ag+(aq)+S2-(aq)��O2��S2-��������Sʱ��Ag+���������NaCl�д�����Cl-�������Ag+��ϳ�AgCl������ʹ���ܽ�ƽ�����ƣ�B�����ճ������ɫ����AgCl��S
2Ag+(aq)+S2-(aq)��O2��S2-��������Sʱ��Ag+���������NaCl�д�����Cl-�������Ag+��ϳ�AgCl������ʹ���ܽ�ƽ�����ƣ�B�����ճ������ɫ����AgCl��S
��������
(1)���еİ�ɫ������NaCl��AgNO3��Һ������Ӧ���ɡ�
(2)���г����ɰױ�ڣ��������ɫ������S2-��Ӧ������Ag2S�����ȡ�
(3)��.��X�еμ�Ba(NO3)2��Һ��������ɫ������˵���˳���ΪBaSO4��
��.��Y�еμ�KI��Һ��������ɫ������˵��AgClת��ΪAgI��
�������жϣ���ȷ����ҺX�б���������ӡ�
����һ�ֳ���Ӧ�ܱ�Ũ��������������SO42-��NO2�ȡ�
(4)��A�У�MnO2��H2O2�ֽ�Ĵ������ɴ�ȷ����������ijɷ֡�
����ΪC�����Ա�ʵ��������ģ��ɴ˿�ȷ��C��ʢ�ŵ�����W��
��B�У���Ӧ�ﻹ��NaCl��O2���������������������S���ɴ˿����Ʒ���ʽ��
��B�У�Ag2S����������S����Ag+����NaCl���ã��Ӷ��ٽ�ƽ�������ƶ���
(1)���еİ�ɫ������NaCl��AgNO3��Ӧ���ɣ���ΪAgCl����Ϊ��AgCl��
(2)���г����ɰױ�ڣ��������ɫ������S2-��Ӧ������Ag2S�����ȣ���Ӧ�����ӷ���ʽΪ2AgCl(s)+S2-(aq)=Ag2S(s)+2Cl-(aq)����Ϊ��2AgCl(s)+S2-(aq)=Ag2S(s)+2Cl-(aq)��
(3)��.��X�еμ�Ba(NO3)2��Һ��������ɫ������˵���˳���ΪBaSO4��
��.��Y�еμ�KI��Һ��������ɫ������˵��AgClת��ΪAgI��
�������жϣ���ȷ����ҺX�б����������ΪSO42-����Ϊ��SO42-��
����һ�ֳ���Ӧ�ܱ�Ũ��������������SO42-��NO2�ȣ�����ΪS����Ϊ��S��
(4)��A�У�MnO2��H2O2�ֽ�Ĵ������ɴ�ȷ����������ΪO2����Ϊ��O2��
����ΪC�����Ա�ʵ��������ģ��ɴ˿�ȷ��C��ʢ�ŵ�����WΪAg2S������Һ����Ϊ��Ag2S������Һ��
��B�У���Ӧ�ﻹ��NaCl��O2���������������������S���ɴ˿ɵó���ƽ�ķ���ʽΪ2Ag2S��1O2��4NaCl��2H2O=4AgCl��2S��4NaOH����Ϊ��2Ag2S��1O2��4NaCl��2H2O=4AgCl��2S��4NaOH��
��B�У�Ag2S��O2��������S����Ag+�������������NaCl�е�Cl-��ϣ�����AgCl�������Ӷ��ٽ�ƽ�������ƶ���B �����ճ������ɫ����AgCl��S����Ϊ�������ܽ�ƽ��Ag2S(s)![]() 2Ag+(aq)+S2-(aq)��O2��S2-��������Sʱ��Ag+���������NaCl�д�����Cl-�������Ag+��ϳ�AgCl������ʹ���ܽ�ƽ�����ƣ�B�����ճ������ɫ����AgCl��S��
2Ag+(aq)+S2-(aq)��O2��S2-��������Sʱ��Ag+���������NaCl�д�����Cl-�������Ag+��ϳ�AgCl������ʹ���ܽ�ƽ�����ƣ�B�����ճ������ɫ����AgCl��S��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������е��л�������ḻ������ʳס�еȶ��Ӧ�ù㷺�������Ҵ��DZȽϳ������л��
��1���Ҵ�����ɫ��������ζ��Һ�壬�ܶȱ�ˮ_______��
��2����ҵ������ϩ��ˮ��Ӧ���Ƶ��Ҵ����÷�Ӧ�Ļ�ѧ����ʽΪ__________________(��д��Ӧ����)��ԭ����������______________��
��3�������Ҵ���ͬ���칹�����_______(ѡ����)��
A��![]() B��
B��![]() C���״� D��CH3��O��CH3 E��HO��CH2CH2��OH
C���״� D��CH3��O��CH3 E��HO��CH2CH2��OH
��4���Ҵ��ܹ�����������Ӧ��
�� 46 g�Ҵ���ȫȼ������_______mol������
�� �Ҵ���ͭ�������������¿ɱ���������Ϊ��ȩ����Ӧ�Ļ�ѧ����ʽΪ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�С������ú��ȵ��л���A�ϳ���֯�����̿���������M��·������(���ַ�Ӧ�Լ�������δע��)��

��֪����E�ķ���ʽΪC5H8O4���ܷ���ˮ�ⷴӦ���˴Ź���������ʾE��������2�ֲ�ͬ��ѧ��������ԭ�ӣ��������Ϊ3��1��

(R��R�䡢R�������ͬ����ͬ������)��
(1)A�����еĺ��������ŵ�������________________��
(2)D��E��Ӧ�Ļ�ѧ����ʽ��____________��
(3)A��B��Ӧ������Լ���________________��
(4)G��H��Ӧ�Ļ�ѧ����ʽ��____________��
(5)��֪1 mol E��2 mol J��Ӧ����1 mol M����M�Ľṹ��ʽ��________��
(6)E��ͬ���칹�����������ʣ�������NaHCO3��Ӧ����CO2�����ܷ���ˮ�ⷴӦ����ˮ�����֮һ�ܷ���������Ӧ�����ͬ���칹�干��________�֣���������1�ֵĽṹ��ʽ��________��
(7)J�ɺϳɸ߷��ӻ�����ø߷��ӻ�����Ľṹ��ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������X��һ�ֻ������أ�������ͼת����ϵ��
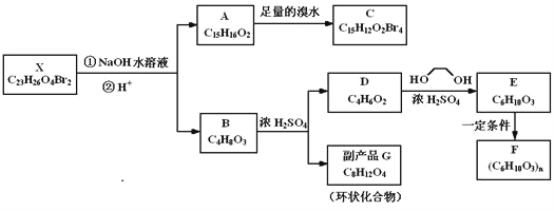
������A����FeCl3��Һ������ɫ��Ӧ�������к���������ѧ������ȫ��ͬ�ļ����䱽���ϵ�һ����ȡ����ֻ�����֡�1H��NMR����ʾ������G��������ԭ�ӻ�ѧ������ͬ��F��һ�ֿ������Ʊ������۾��ĸ߾������������Ϣ�ش��������⣺
(1)����������ȷ����__��
a.������A�����к��������ṹ��Ԫ
b.������A���Ժ�NaHCO3��Һ��Ӧ���ų�CO2����
c.X��NaOH��Һ��Ӧ��������1mol X�������6mol NaOH
d.������D����Br2�����ӳɷ�Ӧ
(2)������C�Ľṹ��ʽ��__��A��C�ķ�Ӧ������__��
(3)д��ͬʱ��������������D������ͬ���칹��Ľṹ��ʽ(�����������칹)__��
a.�������� b.�ܷ���������Ӧ
(4)д��B��G��Ӧ�Ļ�ѧ����ʽ__��
(5)д��E��F��Ӧ�Ļ�ѧ����ʽ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������˷ܼ�����ϳ�·����ͼ��ʾ��
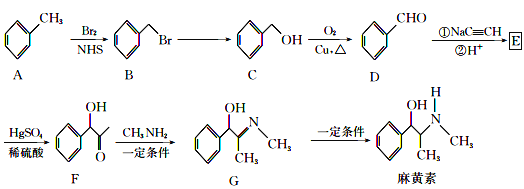
��֪��CH3C![]() CH+H2O
CH+H2O![]()
(1)F�еĹ����ŵ�����Ϊ__��
(2)B��C�ķ�Ӧ������__����Ӧ������__��E�Ľṹ��ʽΪ__��
(3)д��C��D�Ļ�ѧ��Ӧ����ʽ__��
(4)����صķ���ʽΪ__��
(5)H��G��ͬϵ�Ҳ�����ǻ���̼��˫������Է���������GС28���ұ����Ͻ���һ����������H�Ŀ��ܽṹ��___�֣�������![]() �ṹ����
�ṹ����
(6)��֪��R-C![]() C-R
C-R![]() R-CH=CH-R���������������ͼ�ϳ�·�ߣ�������Ҵ�Ϊ��ʼ��ԭ�Ϻϳ�ǿ��ˮ����֬
R-CH=CH-R���������������ͼ�ϳ�·�ߣ�������Ҵ�Ϊ��ʼ��ԭ�Ϻϳ�ǿ��ˮ����֬![]() �ĺϳ�·�ߣ������Լ����ܼ���ѡ__��
�ĺϳ�·�ߣ������Լ����ܼ���ѡ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͭ(Cu2O)��һ����;�㷺�Ĺ����ϣ�ij��������ͭ��ʯ(��CuFeS2��Cu2S��)Ϊԭ����ȡCu2O�Ĺ����������£�
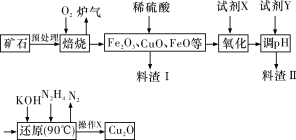
�����¼������ʿ�ʼ�γɳ�������ȫ����ʱ��pH���±���
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
��ʼ���� | 7.5 | 2.7 | 4.8 |
��ȫ���� | 9.0 | 3.7 | 6.4 |
(1)¯���е��к�����ɷ���__________(�ѧʽ)��Cu2S��O2��Ӧʱ���������뻹ԭ�������ʵ���֮��Ϊ__________��
(2)���Լ�X��H2O2��Һ������������Ӧ�����ӷ���ʽΪ____________________����д��H2O2�ĵ���ʽ��__________�����Լ�X��__________ʱ���������ڽ��������ɱ���
(3)�����Լ�Y��pHʱ��pH�ĵ��ط�Χ��__________��
(4)����X����__________��ϴ�ӡ���ɣ����к��ʱҪ������������Ŀ����_________��
(5)��ͭ��ʯī���缫�����Ũ��ǿ������Һ���Ƶ�����Cu2O��д������������Cu2O�ĵ缫��Ӧʽ��____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���pH��12��NaOH��Һƽ���ֳ����ݣ�һ�ݼ�ˮV1 L����һ�ݼ������NaOH��Һ���ʵ���Ũ����ȵ�����V2 L��pH��������1����V1 :V2 Ϊ����Һ������Ե��ӣ�
A. 10 : 1 B. 11 : 1 C. 20 : 1 D. 21 : 1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ��ȷ���ǣ�ע��![]() �ľ���ֵ����ȷ��( )
�ľ���ֵ����ȷ��( )
A.C2H5OH(l)+3O2(g)=2CO2(g) +3H2O(g)����H= ��1367.0 kJ/mol��ȼ���ȣ�
B.NaOH(aq) + HCl(aq)=NaCl(aq)+ H2O(l)����H= ��57.3kJ/mol���к��ȣ�
C.S(s) + O2(g) = SO2(g)����H= ��269.8kJ/mol����Ӧ�ȣ�
D.2HCl(g)=Cl2(g) + H2(g)����H= �� 184.6kJ/mol����Ӧ�ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)����Na2CO3��NaHCO3���ְ�ɫ�������ʣ�
������̽��Na2CO3��NaHCO3�ȶ��Ե����ǿ������ͬѧ�ֱ��������������װ�ã�

��ش�
�����ͼ��ʾ���ֱ���Na2CO3��NaHCO3��ʵ�飬�Թܢ��е��Լ���______������ĸ��ţ���
a. ϡH2SO4 b. NaOH��Һ c. Ca(OH)2��Һ
������ͼ��ʾ���Թܢ���װ��Ĺ���Ӧ����______________���ѧʽ����
��ͨ������ʵ�飬�ó��Ľ����ǣ�Na2CO3��NaHCO3���ȶ���______(����ǿ����������)��
�����������ֹ������ʿ�ѡ�õ��Լ���_____________��
�����ʵ���Ũ�ȵ��������ʵ���Һ��ͬŨ�ȵ����ᷴӦ����Ӧ���ʿ����_________���ѧʽ����
(2)�ס��ҡ�����λͬѧ�ֱ�����������ʵ��װ�ü���ѧҩƷ�����м�ʯ��Ϊ�����������ƺ���ʯ�ҵĻ�����ȡ��������ش��������⣺



��ʵ������ȡ�����Ļ�ѧ����ʽΪ��________________________________________��
����λͬѧ������װ����ȡ����ʱ,������һλͬѧû���ռ����������������ǵ�ʵ���������ȷ��������Ϊû���ռ���������ͬѧ��___________�������������������������������ռ�������������Ҫԭ����___________________________���û�ѧ����ʽ��ʾ����
�ۼ��鰱���Ƿ��ռ����ķ����ǣ�������������������ͽ��ۣ�_______________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com