
����Ŀ����¯����ʱ�ô���������������Ʒ�����ݲ��������ȷ���л������ɣ���ͼװ������ȼ�շ�ȷ���л���M����ʽ�ij���װ�á�
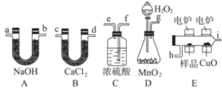
��1�������������������ҷ�����������ѡװ�ø����ܵ�����˳����______________________��
��2��Cװ����Ũ�����������___________________��
��3�� ��ȷ��ȡ�л���M (ֻ��C��H��O����Ԫ���е����ֻ�����) 0.70 g�������ȼ�պ�A����������2.2 g��B����������0.9 g������л����ʵ��ʽΪ__________________��
��4����֪����ͬ�����¸�M��������������ܶ�Ϊ35����M�ķ���ʽΪ_____________�����л���M����ʹ��ˮ��ɫ������˴Ź�������ֻ��һ�����շ壬��M�Ľṹ��ʽΪ________________�������л���M����������̼ԭ��һ������ͬһƽ���ڣ�����ʹ��ˮ��ɫ���ڴ�������������H2�ӳɣ���ӳɲ�������к���3��������M�Ľṹ��ʽΪ_______________________��
���𰸡�g��f��e��h��i��c����d����d����c����a����b����b����a�� ����O2 CH2 C5H10 ![]()
![]()
��������
��1��Dװ�ò��������к���ˮ��Ӧ���������ſ����л��ﷴӦ�����ɶ�����̼��ˮ������ˮ�Ȼ�������ˮ���ü�ʯ����ˮ������̼������װ��ΪD��C��E��B��A������ܵ����˿��Եߵ��������ܽӿ�˳��Ϊg��f��e��h��i��c����d����d����c����a����b����b����a����
��2��C��Ũ��������������ˮ�֣��õ����﴿����O2 ����Ũ����������Ǹ���������
��3��EΪ�л���ȼ��װ�ã�B��CaCl2���շ�Ӧ���ɵ�H2O��A��NaOH���շ�Ӧ���ɵ�CO2��m(CO2)=2.2g��n(CO2)=0.05mol��m(H2O)=0.9g����n(H2O)=0.05 mol��m(C)+m(H)=0.05 mol �� 12 g/mol + 0.05 mol �� 2 g/mol = 0.7g�������л����в�����Ԫ�أ����л����C��H����Ԫ�ص�ԭ�Ӹ�������n(C)��n(H)=0.05����0.05��2��=1��2���ʸ��л�������ʽΪCH2��
��4����֪����ͬ�����¸�M��������������ܶ�Ϊ35��M����Է�������Ϊ��35��2=70����M�ķ���ʽΪ��CH2��n����n=70��14=5��M�ķ���ʽΪC5H10�����л���M����ʹ��ˮ��ɫ������˴Ź�������ֻ��һ�����շ壬˵��M�в����ڲ����ͼ���Ӧ�ú���1��̼�����䲻����֧������MΪ�����飬��ṹ��ʽΪ��![]() �������л���M����������̼ԭ��һ������ͬһƽ���ڣ�����ʹ��ˮ��ɫ���ڴ�������������H2�ӳɣ���ӳɲ�������к���3������˵��M�����к���1��̼̼˫����4��Cԭ�Ӷ�������̼̼˫���ϣ���M�Ľṹ��ʽΪ
�������л���M����������̼ԭ��һ������ͬһƽ���ڣ�����ʹ��ˮ��ɫ���ڴ�������������H2�ӳɣ���ӳɲ�������к���3������˵��M�����к���1��̼̼˫����4��Cԭ�Ӷ�������̼̼˫���ϣ���M�Ľṹ��ʽΪ![]() ��
��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ǹ����Ϲ��ϵĶԻ���������Ⱦ������ɱ��������������Ϊ���壬������ˮ�������ֽ⡣�״������Ʊ��������ȵĹ�����ͼ��
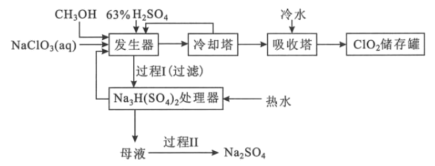
�ش��������⣺
��1��ClO2������ֽ��Ư�ס�ɱ���������������___�ԡ�
��2������������������Ũ������ϡ��Ϊ63%H2SO4����ȴ����뷴Ӧ����ԭ����___��ʵ�ʲ������������������м�������NaCl�Լӿ췴Ӧ���ʣ���NaCl�����ᷢ������Ⱦ������һ������ķ���ʽΪ___��
��3����1molCH3OH��Ӧʱת��6mole-���������������з�����Ӧ����Ҫ��ѧ����ʽΪ___��
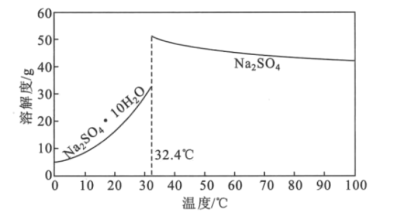
��4��Na2SO4��10H2O��Na2SO4���ܽ��������ͼ��ʾ���������̢����IJ����ǣ�����Ũ�����д�������������___���������Na2SO4���塣
��5�����ö��Ե缫Ϊ������ͨ���������������Һ�ķ���Ҳ�����Ʊ��������ȣ��������ĵ缫��ӦʽΪ___��
��6����״����Ʊ�����������ȣ���ⷨ���ŵ���___��д��2�㣩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������X���������ֶ�����Ԫ�أ���һ������⻯��Ĵ�����ϣ���400���·ֽ⣬�ų�������X��ij��Ԫ�صĵ��ʳ����������źŵ����̻�ij�о�С��Ϊ��̽��A����ɺ����ʣ���Ʋ����������ʵ�顣������������--ȫ���ɽ���Ԫ����ɵĻ����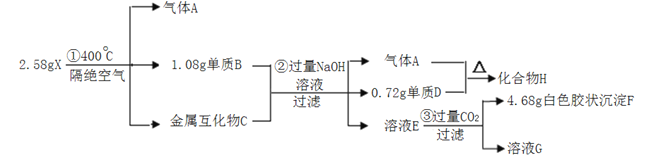
��1��д������D��Ӧ�������ӽṹʾ��ͼ��_____��
��2��X��400���·ֽ�Ļ�ѧ����ʽ��_____��
��3��д������B��NaOH��Һ��Ӧ�����ӷ���ʽ��____��
��4��������H___(����������������������)��ˮ������Ӧ����H2���ж�����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������100mL1.0 mol/L Na2SO4��Һ����ȷ�ķ�����( )
�ٽ�14.2 g Na2SO4������100mLˮ��
�ڽ�32.2g Na2SO410H2O��������ˮ�У�����ˮϡ����100 mL
�۽�20 mL 5.0 mol/L Na2SO4��Һ��ˮϡ����100 mL
A.�٢�B.�ڢ�C.�٢�D.�٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SO2 ����ѧ��ѧ�еij������壬Ҳ�Ǵ�����Ⱦ�����Ҫ��ɳɷ֡��ش��������⣺

�ż���ͬѧ��������װ���Ʊ����ռ������ SO2��

װ�â���ʢװ�������Ƶ�����������_______��װ�� II �������Ƕ� SO2 ������и����װ������ʢ �Լ�����Ϊ_________��װ�� III Ϊ����װ�ã�Ӧѡȡ���� III �еļ���װ��Ϊ___________��ѡ����ĸ���ţ���
������ͬѧ��������װ���Ʊ� SO2 ��̽�������ʣ�

�ٸ���ͬѧ��ʵ��װ���У��������ӵĺ���˳��Ϊa��_________��װ��C�б���NaHSO3��Һ��������________��
����֤��SO2���л�ԭ�Ե�������___________���÷�Ӧ�����ӷ���ʽΪ_________________��
��װ��B����������SO2β������װ����ʢװ���Լ���_______________��
�����ʵ��֤��H2SO3Ϊ������ʣ�________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)д���������ӷ���ʽ���Ӧ�Ļ�ѧ����ʽ
�� Ca2+ + CO32�� �� CaCO3�� ��ѧ����ʽ��____________________________________________________________
�� Cu2+ + Fe �� Fe2+ + Cu ��ѧ����ʽ��_____________________________________________________________
(2)��ӡˢ��·ʱ�����Ȼ�����Һ��ͭ���Ȼ�����Һ��ʴ�ķ���ʽΪ2FeCl3+Cu=2FeCl2+CuCl2��������������_________������������________��д�����ӷ���ʽ����˫���ű�����ӵ�ʧ��________________��
(3)��ȥ�Ȼ�����Һ�е��Ȼ����������Լ�________���ѧʽ�������������ӷ�Ӧ����ʽΪ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CN-��Ʒ�ˮ��һ�ַ�����ͼ��CN-��CNO-��N�Ļ��ϼ۾�Ϊ-3�ۣ�

ijѧϰС��������������������ͼʵ��װ�ý��иõ�Ʒ�ˮ�������о���
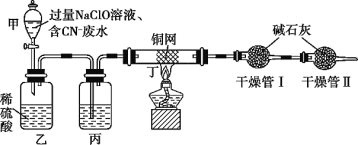
��������:
�����ȹر�װ�üĻ������ٽ���CN-��ˮ�����NaClO��Һ��ϣ�ȡ200mL���Һ[����c(CN-)�൱��0.200mol��L-1]����װ�ü��С�
������װ�ü��г�ַ�Ӧ������ʹ��Һȫ������װ�����У��رջ�����
�����ⶨ����ܢ����ӵ�������
(1)װ�üײ�����������Ϊ________________��װ�����з�Ӧ�����ӷ���ʽΪ________________��
(2)װ�ñ��е��Լ���________________��װ�ö���������________________��
(3)�ٶ�����ʵ���е����嶼��������ա�������ܢ�����1.408g����CN-�������İٷ���Ϊ________________��
(4)����Ϊ�ô�װ�ý���ʵ�飬CN-ʵ�ʱ������İٷ����루3���бȽϻ�________________(�ƫ�ߡ�����ƫ�͡�������ȷ��������Ӱ�족)�������������________________��
���ο�����Ⱦ��ȼú�������Ҫ��Ŀǰ����ѧ�Ҷ�Fe3+��Һ���������о���ȡ���³ɹ���
(5)ijѧϰС��Ϊ��̽����SO2��Fe3+��Ӧ�IJ������������SO2ͨ��FeCl3��Һ�к�ȡ10mL��ӦҺ�ֱ������ΪA��B��C���Թ��У����������3��ʵ�鷽��:
�����٣�A�м�������KMnO4��Һ����Һ�Ϻ�ɫ��ȥ��
�����ڣ�B�м���KSCN��Һ����Һ����죬�ټ������Ƶ���ˮ����Һ��졣
�����ۣ�C�м���ϡ�����ữ��BaCl2��Һ��������ɫ������
����ʵ�鷽���в���������________________�������ţ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ��һ����Ҫ�Ļ���ԭ�ϣ��ɲ����ұ������ⷨ�Ʊ�����Ӧ���£� ![]() (g)
(g)![]()
 (g)+H2(g) ��H=+17.6kJ/mol��
(g)+H2(g) ��H=+17.6kJ/mol��
(1)���¶Ⱥ�ѹǿ�Ƕȷ�������ұ�ƽ��ת���ʿɲ�ȡ�Ĵ�ʩ��___________��
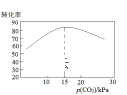
(2)��ҵ�ϣ�ͨ�����ұ������в���ˮ����(ԭ�������ұ���ˮ���������ʵ���֮��Ϊ1:4)�����������ѹ���ұ�ת������ʱ��仯�����ͼ��ʾ��
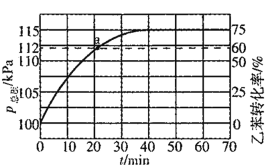
�ٲ���ˮ����������ұ���ƽ��ת���ʣ�����˵������ʵ__________��
ƽ�ⳣ��Kp=_______kPa(KpΪ�Է�ѹ��ʾ��ƽ�ⳣ��)
�ڷ�Ӧ����V=V��-V��=k��P�ұ�-k��p����ϩp������k����k���ֱ�Ϊ���淴Ӧ���ʳ���������a����![]() ______��
______��
(3)CO2�������ұ��������ͬʱ����ͼ1����;����
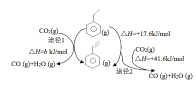
��b=_______kJ/mol��
��;��I�ķ�Ӧ����ͼ��ʾ������˵����ȷ����______________��
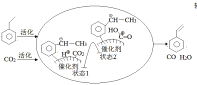
a��CO2������
b��״̬1��״̬2�γ���O-H��
c���м����ֻ��(![]() )
)
d���ô���������ұ���ƽ��ת����
������ͬ�������У���ͬp(CO2)�������£�������ͬ�ķ�Ӧʱ�䣬p(CO2)���ұ�ת���ʹ�ϵ��ͼ��������p(CO2)Ϊ15kPaʱ�ұ�ת������ߵ���____________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com