
【题目】将一定量的镁和铜组成的混合物加入到足量的稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g。下列叙述错误的是
A. 当金属全部溶解时,电子转移的数目为0.3NA
B. 参加反应的金属的总质量3.6g<w<9.6g
C. 当金属全部溶解时,产生的NO气体的体积在标准状况下为2.24L
D. 当生成的沉淀量达到最大时,消耗NaOH溶液的体积为l00mL
【答案】D
【解析】
将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),发生反应3Mg+8HNO3 (稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3 (稀)=3Cu(NO3)2+2NO↑+4H2O;向反应后的溶液中加入过量的3mol/LNaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为n=![]() ,根据电子转移守恒,则镁和铜的总的物质的量为0.15mol。
,根据电子转移守恒,则镁和铜的总的物质的量为0.15mol。
A.根据上述分析可知:反应过程中电子转移的物质的量等于氢氧根离子的物质的量,n(e-)=n(OH-)=0.3mol,所以转移的电子数目N=0.3NA,A正确;
B.镁和铜的总的物质的量为0.15mol,若全为Mg,其质量是m=0.15mol×24g/mol=3.6g;若全为金属Cu,其质量为m=0.15mol×64g/mol=9.6g,所以参加反应的金属的总质量(m)为3.6g<m<9.6g,B正确;
C.反应过程中转移电子的物质的量为0.3mol,根据电子转移数目相等,可知反应产生NO的物质的量为n(NO)=![]() ,其在标准状况下的体积V=0.1mol×22.4L/mol=2.24L,C正确;
,其在标准状况下的体积V=0.1mol×22.4L/mol=2.24L,C正确;
D.若硝酸无剩余,则参加反应氢氧化钠的物质的量等于0.3mol,需要氢氧化钠溶液体积V=![]() ;若硝酸有剩余,消耗的氢氧化钠溶液体积大于100mL,D错误;
;若硝酸有剩余,消耗的氢氧化钠溶液体积大于100mL,D错误;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2PO4–)的变化如图1所示,H3PO4溶液中H2PO4–的分布分数![]() 随pH的变化如图2所示,
随pH的变化如图2所示,![]() 下列有关LiH2PO4溶液的叙述正确的是
下列有关LiH2PO4溶液的叙述正确的是
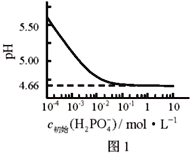
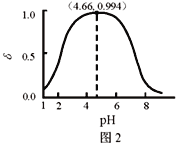
A. 含P元素的粒子有H2PO4–、HPO42–、PO43–
B. LiH2PO4溶液中存在2个平衡
C. 用浓度大于1 mol·L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4
D. 随c初始(H2PO4–)增大,溶液的pH明显变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、G、M六种元素位于元素周期表前四周期,原子序数依次增大。其中,元素A的一种核素无中子,B的单质既有分子晶体又有原子晶体,化合物DE2为红棕色气体,G是前四周期中电负性最小的元素,M的原子核外电子数比G多10。
请回答下列问题:
(1)基态G原子的核外电子排布式是___________,M在元素周期表中的位置是_______,元素B、D、E的第一电离能由大到小的顺序为______________________(用元素符号表示)。
(2)元素A和E组成的阳离子空间构型为__________________________;化合物ABD的结构式为____________,其中B原子的杂化方式为____。

(3)G、M的晶体晶胞结构如图所示,这两种晶胞中原子的配位数之比为___________。若晶体M密度为8.9g·cm-3,则M的晶胞边长是____________________cm(不必计算出结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,发生反应A(g)+B(g)![]() C(g) ΔH<0,达到平衡后根据下列图象判断:
C(g) ΔH<0,达到平衡后根据下列图象判断:
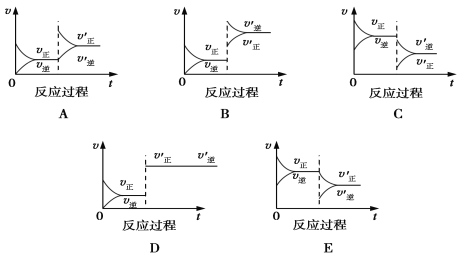
(1)表示升高温度,达到新平衡的是________(填“A”、“B”、“C”、“D”或“E”,下同),新平衡中C的质量分数________(填“增大”、“减小”或“不变”,下同)。
(2)表示降低压强,达到新平衡的是________,A的转化率________。
(3)表示减少C的量,达到新平衡的是______________。
(4)表示增加A的量,达到新平衡的是___________,此时B的转化率__________,A的转化率___________。
(5)表示使用催化剂,达到新平衡的是________________,C的质量分数________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同的方式投入反应物,发生反应 N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol,测得反应的相关数据如下表:
2NH3(g) △H=-92.4kJ/mol,测得反应的相关数据如下表:
容器甲 | 容器乙 | 容器丙 | |
反应温度/℃ | 400 | 400 | 500 |
反应物投入量 | 1molN2,3molH2 | 4molNH3 | 1molN2,3molH2 |
平衡时v(正)(H2)/mol/(Ls) | v1 | v2 | v3 |
平衡时c(NH3)/(mol/L) | c1 | c2 | c3 |
平衡时总压强P/Pa | P1 | P2 | P3 |
物质的平衡转化率a | a1(N2) | a2(NH3) | a3(N2) |
平衡常数K | K1 | K2 | K3 |
下列关系正确的是
A. v1<v2,c1<2c2 B. c2>2c3,a2(NH3)+a3(N2)<1
C. K1>K3, P2>2P3 D. v1<v3,a1(N2)<a3(N2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 任何原子或离子的组成中都含有质子B. 16O2和18O2互称为同素异形体
C. 40K和40Ca原子中的质子数和中子数都相等D. 同位素是不同核素,物理、化学性质完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代的物质文明华夏民族在认识、改造和应用物质方面有着辉煌的历史。
①东晋《抱扑子》中记载:“以曾青涂铁,铁赤色如铜”(“曾青”即硫酸铜溶液)。
②战国《周礼》中记载;“煤饼烧砺房成灰”(“砺房”即牡砺壳,主要成分是碳酸钙)。将“灰”溶于水可制得沤浸树皮脱胶的碱液。
③元代《庚道集》中记载:“点铜戍银”(即单质铜与砷融合形成银白色的物质)
请运用你学过的化学知识回答下列问题;
(1)在①~③中,发生了化学变化的是___(填编号)其中发生分解反应的化学方程式为___。
(2)①中发生变化的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)![]() Y(g)+Z(s),下列选项不能作为反应达到平衡标志的是
Y(g)+Z(s),下列选项不能作为反应达到平衡标志的是
A. 反应容器中压强不再变化 B. 混合气体的密度不再变化
C. 混合气体的平均相对分子质量不再变化 D. Z的浓度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用乙醇、乙酸和浓硫酸制备乙酸乙酯,分别设计了甲、乙两套装置。按图连接好装置,添加试剂后用酒精灯对左边试管小火加热3~5min后,改用大火加热,当观察到右边试管中有明显现象时停止实验。已知:乙酸乙酯的沸点为77°C,乙醇的沸点为78.5°C,乙酸的沸点为117.9°C。

(1)写出甲装置左边试管中主要发生的反应的化学方程式:______。
(2)加入的浓硫酸作用为____,装置乙中球形干燥管的作用是_____。
(3)反应开始时用酒精灯对左边试管小火加热的原因是________。
(4)停止加热后,振荡a、b两试管发现油状液体层变薄,其主要原因可能是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com