
【题目】某学习小组用乙醇、乙酸和浓硫酸制备乙酸乙酯,分别设计了甲、乙两套装置。按图连接好装置,添加试剂后用酒精灯对左边试管小火加热3~5min后,改用大火加热,当观察到右边试管中有明显现象时停止实验。已知:乙酸乙酯的沸点为77°C,乙醇的沸点为78.5°C,乙酸的沸点为117.9°C。

(1)写出甲装置左边试管中主要发生的反应的化学方程式:______。
(2)加入的浓硫酸作用为____,装置乙中球形干燥管的作用是_____。
(3)反应开始时用酒精灯对左边试管小火加热的原因是________。
(4)停止加热后,振荡a、b两试管发现油状液体层变薄,其主要原因可能是____。
【答案】CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 催化剂、吸水剂 防倒吸 加快反应速率,同时防止反应物为来得及反应而挥发损失 挥发出的乙酸能够与碳酸钠溶液反应(或乙醇溶于碳酸钠溶液)
CH3COOCH2CH3+H2O 催化剂、吸水剂 防倒吸 加快反应速率,同时防止反应物为来得及反应而挥发损失 挥发出的乙酸能够与碳酸钠溶液反应(或乙醇溶于碳酸钠溶液)
【解析】
(1)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水;
(2)由于酯化反应是可逆反应,浓硫酸具有吸水性,在乙酸与乙醇发生酯化反应时做催化剂和吸水剂;乙醇、乙酸易挥发,从导管中导出的气体中除了含有乙酸乙酯外还含有易溶于水的乙醇、乙酸,通入饱和碳酸钠溶液容易产生倒吸;
(3)升高温度可以加快反应速率,同时乙醇、乙酸易挥发;
(4)从导管中导出的气体中除了含有乙酸乙酯外还含有乙醇、乙酸,乙醇易溶于水,乙酸能够与碳酸钠溶液反应
(1)甲装置左边试管中乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,反应的化学方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(2)由于酯化反应是可逆反应,浓硫酸具有吸水性,在乙酸与乙醇发生酯化反应时做催化剂和吸水剂;乙醇、乙酸易挥发,从导管中导出的气体中除了含有乙酸乙酯外还含有易溶于水的乙醇、乙酸,通入饱和碳酸钠溶液容易产生倒吸,则装置乙中球形干燥管的作用是防止产生倒吸现象,故答案为:催化剂、吸水剂;防倒吸;
(3)升高温度可以加快反应速率,同时乙醇、乙酸易挥发,所以温度不能过高,防止反应物为来得及反应而挥发损失,应用小火加热,故答案为:加快反应速率,同时防止反应物为来得及反应而挥发损失;
(4)乙醇、乙酸易挥发,从导管中导出的气体中除了含有乙酸乙酯外还含有乙醇、乙酸,乙醇易溶于水,乙酸能够与碳酸钠溶液反应,导致停止加热后,振荡a、b两试管发现油状液体层变薄,故答案为:挥发出的乙酸能够与碳酸钠溶液反应(或乙醇溶于碳酸钠溶液)。


科目:高中化学 来源: 题型:
【题目】将一定量的镁和铜组成的混合物加入到足量的稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g。下列叙述错误的是
A. 当金属全部溶解时,电子转移的数目为0.3NA
B. 参加反应的金属的总质量3.6g<w<9.6g
C. 当金属全部溶解时,产生的NO气体的体积在标准状况下为2.24L
D. 当生成的沉淀量达到最大时,消耗NaOH溶液的体积为l00mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是

A. 4>2>1>3>5>6 B. 4>6>2>1>3>5 C. 5>4>2>3>1>6 D. 6>3>5>2>4>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。目前,世界各国已高度重视这个问题,并采取积极措施进行治理。
(1)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法都正确的是__________(填字母编号,可多选)。

(2)下图是某市污水处理的工艺流程示意图:

①下列物质中不可以作为混凝剂(沉降剂)使用的是______(填字母编号,可多选)。
A.偏铝酸钠 B.氧化铝
C.碱式氯化铝 D.氯化铁
②混凝剂除去悬浮物质的过程是________(填字母编号)。
A.物理变化 B.化学变化
C既有物理变化又有化学变化
(3)在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
某厂废水中含KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应:KCN+2KOH+Cl2===KOCN+2KCl+H2O再投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式:
___KOCN+___KOH+___Cl2―→___CO2+___N2+___KCl+___H2O。若处理上述废水20 L,使KCN完全转化为无毒物质,至少需液氯__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的叙述正确的是( )
A.负极发生的电极反应是还原反应B.能将化学能转化为电能
C.工作时其正极上不断产生电子并经外电路流向负极D.电极只能由两种不同的金属构成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某体积固定的密闭容器中加入2 mol A和1 mol B,发生可逆反应2A(g)+ B(g) ![]() 3C(g) ΔH = - a kJ/mol,下列说法正确的是
3C(g) ΔH = - a kJ/mol,下列说法正确的是
A. 当容器内压强不变时说明反应已达到平衡
B. 当反应达到平衡时c(A):c(B):c(C) = 1:2:3
C. 当反应达到平衡时放出热量a kJ
D. 其他条件不变,升高温度反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 将1 mol N2和3 mol H2置于密闭容器中充分反应,形成N-H键的数目为6 NA
B. 22.4 L D2中含有的中子数目为2 NA
C. 7.8 g Na2O2中含有的离子数为0.4 NA
D. 常温常压下,1 mol氯气与足量的NaOH溶液完全反应转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌浮渣主要含Zn、ZnO、SiO2、Fe2+、Cd2+、Mn2+,工业上可通过控制条件逐一除去杂质以制备超细活性氧化锌,其工艺流程如下:
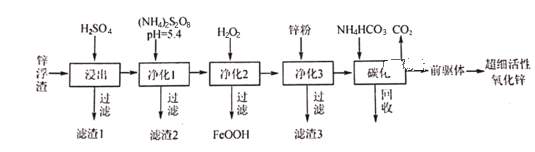
(1)滤渣1的成分为___________。
(2)在S2O82-的结构式中只含有一根“O一O”非极性键,则S的化合价为___________;工业上常用惰性电极电解(NH4)2SO4生产(NH4)2S2O8(过二硫酸铵),阳极电极反应式为__________________。净化1是为了将Mn2+转化为MnO2而除去,写出该反应的离子方程式:______________________。
(3)净化3的目的_________________________________。
(4)碳化回收溶液的主要成分为___________,该物质循环使用的目的___________________。
(5)碳化在50℃进行,“前驱体”的化学式为ZnCO3·2Zn(OH)2·H2O,写出碳化过程生成“前驱体”的化学方程式:__________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com