
【题目】一定温度下,在某体积固定的密闭容器中加入2 mol A和1 mol B,发生可逆反应2A(g)+ B(g) ![]() 3C(g) ΔH = - a kJ/mol,下列说法正确的是
3C(g) ΔH = - a kJ/mol,下列说法正确的是
A. 当容器内压强不变时说明反应已达到平衡
B. 当反应达到平衡时c(A):c(B):c(C) = 1:2:3
C. 当反应达到平衡时放出热量a kJ
D. 其他条件不变,升高温度反应速率加快
【答案】D
【解析】
A. 反应体系是气体体积不变的化学反应;
B. 平衡状态时各物质的物质的量浓度之比无法判断;
C. 反应为可逆反应,不能完全转化;
D. 升高温度反应速率加快;
A. 体积固定的密闭容器中,该反应体系是气体体积不变的化学反应,则当容器内压强不变时不能说明反应已达到平衡,故A项错误;
B. 当反应达到平衡时,各物质的物质的量浓度保持不变,但无法确定其浓度比是否等于化学计量数之比,故B项错误;
C. 因反应为可逆反应,则反应过程中实际放热量在数值上小于焓变量,即小于a kJ,故C项错误;
D. 化学反应速率与温度成正比,当其他条件不变时,升高温度反应速率会加快,故D项正确;
答案选D。


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 任何原子或离子的组成中都含有质子B. 16O2和18O2互称为同素异形体
C. 40K和40Ca原子中的质子数和中子数都相等D. 同位素是不同核素,物理、化学性质完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
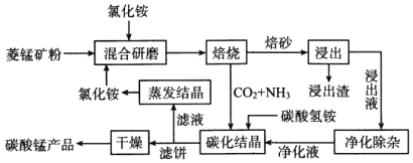
已知:①“焙烧”时发生的主要反应的化学方程式为MnCO3+2 NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O
MnCl2+2NH3↑+CO2↑+H2O
②菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
③相关金属离子[c(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
④常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11。回答下列问题:
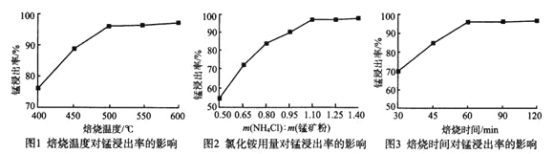
(1)分析下列图1、图2、图3,氯化铵焙烧菱锰矿的最佳条件是:___________。
(2)浸出液“净化除杂”过程如下:①加入MnO2。用离子方程式表示MnO2的作用___________;
②调节溶液的pH,除去Fe3+、Al3+。溶液恰当的pH范围为___________;
③加入NH4F将Ca2+、Mg2+除去,两种沉淀共存时溶液中c(Ca2+)=1×10-5mol·L-1,则c(Mg2+)=___________。
(3)碳化结晶过程中发生反应的离子方程式为______________________。
(4)将制得的高纯度碳酸锰溶于过量稀硫酸后用惰性电极电解,可以得到重要的无机功能材料MnO2,该电极的电极反应式为______________________。
(5)25℃时,向0 .1mol/L NH3·H2O溶液中通入HC1气体,溶液中![]() 与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是___________。
与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是___________。

A.C点的溶液中:c(NH3·H2O)>c(NH4+)
B.NH3·H2O的Kb=1.0×10-4.7
C.pOH=3的溶液中:c(NH4+)+c(H+) +c(NH3·H2O)=0.1mol/L+c(OH-)
D.pOH=7的溶液中的溶质是NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得:5g甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出113.5 kJ的热量。试写出甲醇燃烧的热化学方程式:________________________________________________________。
(2)由气态基态原子形成1 mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
化学键 | H—H | N—H | N≡N |
键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2+3H2===2NH3 ΔH=a kJ·mol-1。试根据表中数据计算a的数值为________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599 kJ·mol-1
根据盖斯定律,计算298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式:
____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用乙醇、乙酸和浓硫酸制备乙酸乙酯,分别设计了甲、乙两套装置。按图连接好装置,添加试剂后用酒精灯对左边试管小火加热3~5min后,改用大火加热,当观察到右边试管中有明显现象时停止实验。已知:乙酸乙酯的沸点为77°C,乙醇的沸点为78.5°C,乙酸的沸点为117.9°C。

(1)写出甲装置左边试管中主要发生的反应的化学方程式:______。
(2)加入的浓硫酸作用为____,装置乙中球形干燥管的作用是_____。
(3)反应开始时用酒精灯对左边试管小火加热的原因是________。
(4)停止加热后,振荡a、b两试管发现油状液体层变薄,其主要原因可能是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA 表示阿伏加德罗常数,下列说法正确的是
A. T℃时,1LpH=6纯水中,含10-8NA个OH-
B. 15.6gNa2O2 与过量CO2反应时,转移的电子数为0.4NA
C. pH=1的H3PO4溶液中含有0.1NA个H+
D. 1molCO和N2混合气体中含有的质子数是14NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关碱金属铷(Rb)的叙述中,正确的是( )
A. 灼烧氯化铷时,火焰有特殊颜色B. 硝酸铷是共价化合物,易溶于水
C. 在钠、钾、铷三种单质中,钠的金属性最强D. 氢氧化铷是弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
K为化学平衡常数,其中K和温度的关系如下表:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
根据以上信息推断以下说法正确的是
A. 此反应为放热反应
B. 此反应只有达到平衡时,密闭容器中的压强才不会变化
C. 此反应达到1 000℃时的反应速率比700℃时大
D. 该反应的化学平衡常数越大,反应物的转化率越低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当今环境污染已成为人类面临的重大威胁,下列对应关系不完全正确的是
A.酸雨——SO2、NO2、CO2等B.光化学烟雾——NO2、CxHy、CO等
C.温室效应——CO2、CH4等D.白色污染——各种颜色的难降解的塑料膜、袋等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com