
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
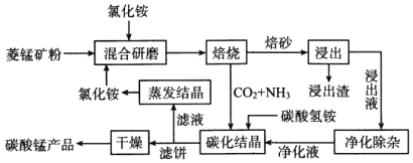
已知:①“焙烧”时发生的主要反应的化学方程式为MnCO3+2 NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O
MnCl2+2NH3↑+CO2↑+H2O
②菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
③相关金属离子[c(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
④常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11。回答下列问题:
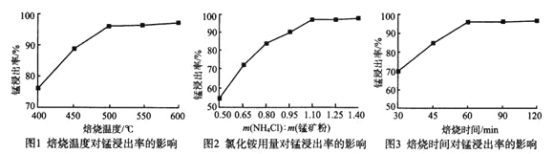
(1)分析下列图1、图2、图3,氯化铵焙烧菱锰矿的最佳条件是:___________。
(2)浸出液“净化除杂”过程如下:①加入MnO2。用离子方程式表示MnO2的作用___________;
②调节溶液的pH,除去Fe3+、Al3+。溶液恰当的pH范围为___________;
③加入NH4F将Ca2+、Mg2+除去,两种沉淀共存时溶液中c(Ca2+)=1×10-5mol·L-1,则c(Mg2+)=___________。
(3)碳化结晶过程中发生反应的离子方程式为______________________。
(4)将制得的高纯度碳酸锰溶于过量稀硫酸后用惰性电极电解,可以得到重要的无机功能材料MnO2,该电极的电极反应式为______________________。
(5)25℃时,向0 .1mol/L NH3·H2O溶液中通入HC1气体,溶液中![]() 与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是___________。
与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是___________。

A.C点的溶液中:c(NH3·H2O)>c(NH4+)
B.NH3·H2O的Kb=1.0×10-4.7
C.pOH=3的溶液中:c(NH4+)+c(H+) +c(NH3·H2O)=0.1mol/L+c(OH-)
D.pOH=7的溶液中的溶质是NH4Cl
【答案】500℃、1.10、60min MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O 5.2![]() pH<8.8 5×10-6mol/L Mn2++2HCO3-
pH<8.8 5×10-6mol/L Mn2++2HCO3-![]() MnCO3+CO2↑+ H2O Mn2++2 H2O-2e-= MnO2+4H+ B
MnCO3+CO2↑+ H2O Mn2++2 H2O-2e-= MnO2+4H+ B
【解析】
(1)按图1、图2、图3的锰浸出率选择最佳条件:焙烧温度、投料比和焙烧时间;
(2)MnO2在酸性条件下将Fe2+氧化为Fe3+,欲使Fe3+、Al3+变为沉淀而除去,溶液的pH![]() 5.2,不使Mn2+沉淀,pH<8.8,从而确定pH范围;根据CaF2的溶度积常数计算出溶液中c(F-),再用MgF2的溶度积常数计算出溶液中的c(Mg2+);
5.2,不使Mn2+沉淀,pH<8.8,从而确定pH范围;根据CaF2的溶度积常数计算出溶液中c(F-),再用MgF2的溶度积常数计算出溶液中的c(Mg2+);
(3)碳化结晶时,可看成Mn(HCO3)2受热分解,类比写出离子方程式;
(4)阳极得到重要的无机功能材料MnO2,失电子发生氧化反应;
(5)A.C点![]() =0,故溶液中:c(NH3·H2O)=c(NH4+);
=0,故溶液中:c(NH3·H2O)=c(NH4+);
B. C点![]() =0,故溶液中:c(NH3·H2O)=c(NH4+),NH3·H2O的Kb=
=0,故溶液中:c(NH3·H2O)=c(NH4+),NH3·H2O的Kb=![]() =c(OH-)=1.0×10-4.7;
=c(OH-)=1.0×10-4.7;
C.pOH=3的溶液中: c(H+) -c(OH-)=10-11-10-3<0,物料守恒有c(NH4+)+c(NH3·H2O)=0.1mol/L,故c(NH4+) +c(NH3·H2O) +c(H+)-c(OH-)<0.1mol/L;
D.若溶液中的溶质是NH4Cl,为强酸弱碱盐,水解显酸性,pOH>7。
(1)由图1可知焙烧温度选择500℃;由图2可知氯化铵和锰矿粉投料比选择1.10;由图3可知焙烧时间选择60min,
因此,本题正确答案为:500℃、1.10、60min;
(2)①MnO2在酸性条件下将Fe2+氧化为Fe3+,离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
②欲使Fe3+、Al3+变为沉淀而除去,溶液的pH![]() 5.2,不使Mn2+沉淀,pH<8.8,从而确定pH范围为5.2
5.2,不使Mn2+沉淀,pH<8.8,从而确定pH范围为5.2![]() pH<8.8;
pH<8.8;
③根据CaF2的溶度积常数计算出溶液中c(F-),再用MgF2的溶度积常数计算出溶液中的c(Mg2+),c(Mg2+)=![]() ×c(Ca2+)=
×c(Ca2+)=![]() ×1×10-5mol/L=5×10-6mol/L;
×1×10-5mol/L=5×10-6mol/L;
因此,本题正确答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;5.2![]() pH<8.8;5×10-6mol/L;
pH<8.8;5×10-6mol/L;
()碳化结晶时,可看成Mn(HCO3)2受热分解,离子方程式为Mn2++2HCO3-![]() MnCO3+CO2↑+ H2O;
MnCO3+CO2↑+ H2O;
因此,本题正确答案为:Mn2++2HCO3-![]() MnCO3+CO2↑+ H2O;
MnCO3+CO2↑+ H2O;
(4)阳极得到重要的无机功能材料MnO2,阳极发生氧化反应,故电极反应式为Mn2++2 H2O-2e-= MnO2+4H+;
因此,本题正确答案为:Mn2++2H2O-2e-= MnO2+4H+;
(5)A.C点![]() =0,故溶液中:c(NH3·H2O)=c(NH4+),故A错误;
=0,故溶液中:c(NH3·H2O)=c(NH4+),故A错误;
B. C点![]() =0,故溶液中:c(NH3·H2O)=c(NH4+),NH3·H2O的Kb=
=0,故溶液中:c(NH3·H2O)=c(NH4+),NH3·H2O的Kb=![]() =c(OH-)=1.0×10-4.7,故B正确;
=c(OH-)=1.0×10-4.7,故B正确;
C.pOH=3的溶液中: c(H+) -c(OH-)=10-11-10-3<0,根据物料守恒有c(NH4+)+c(NH3·H2O)=0.1mol/L,故c(NH4+) +c(NH3·H2O) +c(H+)-c(OH-)<0.1mol/L,故C错误;
D.若溶液中的溶质是NH4Cl,为强酸弱碱盐,水解显酸性,pOH>7,故D错误。
因此,本题正确答案为:B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图。若上端开口关闭,可得到强还原性的H+(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH(烃基自由基)。下列说法错误的是

A. 无论是否鼓入空气,负极的电极反应式均为Fe-2e-=Fe2+
B. 不鼓入空气时,正极的电极反应式为H++e-=H·
C. 鼓入空气时,每生成1mol·OH有2mol电子发生转移
D. 处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示的四种短周期元素 W、X、Y、Z,这四种元素的原子最外层电子数之和为 22,下列说法错误的是( )

A. X、Y 和氢三种元素形成的化合物中可能既有离子键、又有共价键
B. 物质 W3X4 中,每个原子最外层均达到 8 电子稳定结构
C. W 元素的单质是良好的半导体材料,它与 Z 元素可形成化合物 WZ4
D. X、Y、Z 三种元素最低价氢化物的沸点 HZ 最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是

A. 4>2>1>3>5>6 B. 4>6>2>1>3>5 C. 5>4>2>3>1>6 D. 6>3>5>2>4>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语表示:
(1)2个铜离子__________;
(2)氧化铁中铁元素的化合价为+3价_______;
(3)溶于水温度降低的一种盐_________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。目前,世界各国已高度重视这个问题,并采取积极措施进行治理。
(1)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法都正确的是__________(填字母编号,可多选)。

(2)下图是某市污水处理的工艺流程示意图:

①下列物质中不可以作为混凝剂(沉降剂)使用的是______(填字母编号,可多选)。
A.偏铝酸钠 B.氧化铝
C.碱式氯化铝 D.氯化铁
②混凝剂除去悬浮物质的过程是________(填字母编号)。
A.物理变化 B.化学变化
C既有物理变化又有化学变化
(3)在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
某厂废水中含KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应:KCN+2KOH+Cl2===KOCN+2KCl+H2O再投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式:
___KOCN+___KOH+___Cl2―→___CO2+___N2+___KCl+___H2O。若处理上述废水20 L,使KCN完全转化为无毒物质,至少需液氯__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某体积固定的密闭容器中加入2 mol A和1 mol B,发生可逆反应2A(g)+ B(g) ![]() 3C(g) ΔH = - a kJ/mol,下列说法正确的是
3C(g) ΔH = - a kJ/mol,下列说法正确的是
A. 当容器内压强不变时说明反应已达到平衡
B. 当反应达到平衡时c(A):c(B):c(C) = 1:2:3
C. 当反应达到平衡时放出热量a kJ
D. 其他条件不变,升高温度反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中不正确的是( )
A. 盐酸滴在石灰石上:CaCO3+2H+![]() Ca2++H2O+CO2↑
Ca2++H2O+CO2↑
B. 向Ba(OH)2溶液中滴入少量的NaHSO4溶液:H++SO42-+Ba2++OH-![]() BaSO4↓+H2O
BaSO4↓+H2O
C. 向Ba(OH)2溶液中滴入过量的NaHSO4溶液:2H++SO42-+Ba2++2OH-![]() BaSO4↓+2H2O
BaSO4↓+2H2O
D. 稀硫酸滴在铜片上:Cu+2H+![]() Cu2++H2↑
Cu2++H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com