
【题目】用化学用语表示:
(1)2个铜离子__________;
(2)氧化铁中铁元素的化合价为+3价_______;
(3)溶于水温度降低的一种盐_________;
【答案】2Cu2+ ![]() NH4NO3
NH4NO3
【解析】
(1)离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略;(2)元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后;(3)溶于水温度降低的一种盐为硝酸铵;据此分析解答。
(1)离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.故:2个铜离子表示为2Cu2+,故答案为:2Cu2+;
(2)元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,故:氧化铁中铁元素的化合价为+3价,表示为![]() ,故答案为:
,故答案为:![]() ;
;
(3)溶于水温度降低的一种盐为硝酸铵,其化学式为NH4NO3,故答案为:NH4NO3。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】2019年是门捷列夫发现元素周期律150周年。下表列出了①⑧八种元素在周期表中的位置:
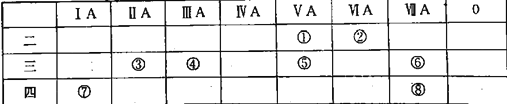
请按要求回答下列问题:
(1)写出元素②质量数为18的的核素符号_______。
(2)甲为③、⑥两元素组成的化合物,用电子式表示甲的形成过程__________。
(3)以上表中元素的最高价氧化物对应的水化物酸性最强的是_______。
(4)元素⑤的简单氢化物和元素①的简单氢化物与卤化氢的反应相似,产物的结构性质也相似。下列对元素⑤的简单氢化物与HI反应产物的推断正确的是_____(填序号)。
A.能与NaOH反应 B.含离子键、共价键 C.能与稀硫酸反应
(5)向元素⑦的单质与水反应后的溶液中加入元素④的单质,发生反应的离子反应方程式为_______。
(6)不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近。写出⑥形成的互化物和SO2在水溶液中发生反应的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种激光染料,它由C、H、O三种元素组成,分子球棍模型如图所下列有关叙述正确的是

①分子式为C10H8O3 ②不溶于水 ③1mol该物质最多能与4molH2加成
④能使酸性KMnO4溶液褪色 ⑤1mol该物质最多能与含2 mol NaOH的溶液反应
A. ①②③④ B. ③④⑤ C. ②③④ D. ②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
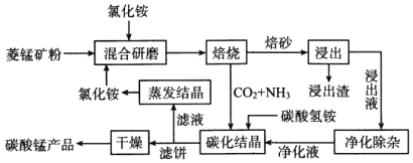
已知:①“焙烧”时发生的主要反应的化学方程式为MnCO3+2 NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O
MnCl2+2NH3↑+CO2↑+H2O
②菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
③相关金属离子[c(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
④常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11。回答下列问题:
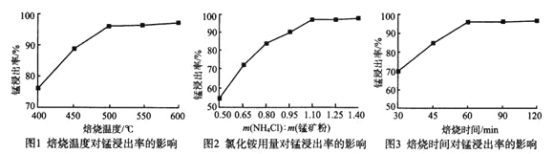
(1)分析下列图1、图2、图3,氯化铵焙烧菱锰矿的最佳条件是:___________。
(2)浸出液“净化除杂”过程如下:①加入MnO2。用离子方程式表示MnO2的作用___________;
②调节溶液的pH,除去Fe3+、Al3+。溶液恰当的pH范围为___________;
③加入NH4F将Ca2+、Mg2+除去,两种沉淀共存时溶液中c(Ca2+)=1×10-5mol·L-1,则c(Mg2+)=___________。
(3)碳化结晶过程中发生反应的离子方程式为______________________。
(4)将制得的高纯度碳酸锰溶于过量稀硫酸后用惰性电极电解,可以得到重要的无机功能材料MnO2,该电极的电极反应式为______________________。
(5)25℃时,向0 .1mol/L NH3·H2O溶液中通入HC1气体,溶液中![]() 与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是___________。
与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是___________。

A.C点的溶液中:c(NH3·H2O)>c(NH4+)
B.NH3·H2O的Kb=1.0×10-4.7
C.pOH=3的溶液中:c(NH4+)+c(H+) +c(NH3·H2O)=0.1mol/L+c(OH-)
D.pOH=7的溶液中的溶质是NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素W的原子结构示意图为![]() ,下列说法不正确的是
,下列说法不正确的是
A. W处于元素周期表的第三周期
B. m=7,W形成的单质可用于自来水消毒
C. m=1,W的最高价氧化物对应的水化物是一种弱碱
D. m=6,W可以形成化学式为WO2的氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得:5g甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出113.5 kJ的热量。试写出甲醇燃烧的热化学方程式:________________________________________________________。
(2)由气态基态原子形成1 mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
化学键 | H—H | N—H | N≡N |
键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2+3H2===2NH3 ΔH=a kJ·mol-1。试根据表中数据计算a的数值为________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599 kJ·mol-1
根据盖斯定律,计算298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式:
____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA 表示阿伏加德罗常数,下列说法正确的是
A. T℃时,1LpH=6纯水中,含10-8NA个OH-
B. 15.6gNa2O2 与过量CO2反应时,转移的电子数为0.4NA
C. pH=1的H3PO4溶液中含有0.1NA个H+
D. 1molCO和N2混合气体中含有的质子数是14NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马来酸氯苯那敏又名扑尔敏(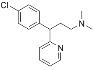 )是一种常见的抗过敏药物,其合成路线如下:
)是一种常见的抗过敏药物,其合成路线如下:
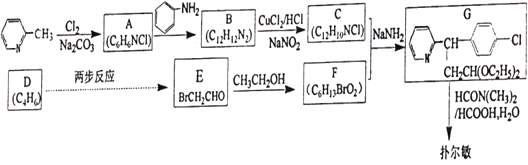
已知:碳碳双键可以被臭氧氧化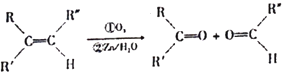
请回答下列问题:
(1)下列说法中不正确的是________。
A.扑尔敏的分子式为C16H18N2Cl
B.G分子中含有两个手性碳原子
C.化合物C中所有原子可能共平面
D.化合物E能发生取代、加成、氧化、还原反应
(2)化合物B的结构简式是________。
(3)E![]() F的化学方程式是________。
F的化学方程式是________。
(4)写出同时符合下列条件的化合物B(C12H12N2)两个同分异构体的结构简式________。
①分子中含有两个六元环;②1H-NMR谱显示有3个峰。
(5)设计由D经两步反应得到E的合成路线(用流程图表示,无机试剂任选)________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com