
【题目】下列各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是

A. 4>2>1>3>5>6 B. 4>6>2>1>3>5 C. 5>4>2>3>1>6 D. 6>3>5>2>4>1
 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
【题目】A、B、D、E、G、M六种元素位于元素周期表前四周期,原子序数依次增大。其中,元素A的一种核素无中子,B的单质既有分子晶体又有原子晶体,化合物DE2为红棕色气体,G是前四周期中电负性最小的元素,M的原子核外电子数比G多10。
请回答下列问题:
(1)基态G原子的核外电子排布式是___________,M在元素周期表中的位置是_______,元素B、D、E的第一电离能由大到小的顺序为______________________(用元素符号表示)。
(2)元素A和E组成的阳离子空间构型为__________________________;化合物ABD的结构式为____________,其中B原子的杂化方式为____。

(3)G、M的晶体晶胞结构如图所示,这两种晶胞中原子的配位数之比为___________。若晶体M密度为8.9g·cm-3,则M的晶胞边长是____________________cm(不必计算出结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代的物质文明华夏民族在认识、改造和应用物质方面有着辉煌的历史。
①东晋《抱扑子》中记载:“以曾青涂铁,铁赤色如铜”(“曾青”即硫酸铜溶液)。
②战国《周礼》中记载;“煤饼烧砺房成灰”(“砺房”即牡砺壳,主要成分是碳酸钙)。将“灰”溶于水可制得沤浸树皮脱胶的碱液。
③元代《庚道集》中记载:“点铜戍银”(即单质铜与砷融合形成银白色的物质)
请运用你学过的化学知识回答下列问题;
(1)在①~③中,发生了化学变化的是___(填编号)其中发生分解反应的化学方程式为___。
(2)①中发生变化的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)![]() Y(g)+Z(s),下列选项不能作为反应达到平衡标志的是
Y(g)+Z(s),下列选项不能作为反应达到平衡标志的是
A. 反应容器中压强不再变化 B. 混合气体的密度不再变化
C. 混合气体的平均相对分子质量不再变化 D. Z的浓度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均是短周期元素,其原子序数依次增大,A和B同周期,A和D同主族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C的阳离子电子层结构相同,C的单质与B的单质在不同条件下反应,可生成C2B或C2B2,E是所在周期中原子半径最小的元素。请回答:
(1)D在元素周期表中的位置是 。
(2)C2B的电子式是 ;AB2的结构式是 。
(3)B、C、E的离子半径由大到小的顺序为 (用化学式回答,下同);A、D、E元素最高价氧化物对应水化物的酸性由强到弱为 。
(4)B的气态氢化物与H2S相比沸点高的是 (用化学式回答);原因是 。
(5)水中锰含量超标,容易使洁具和衣物染色,使水产生异味,EB2可以用来除去水中超标的Mn2+,生成黑色沉淀MnO2,当消耗13.50gEB2时,共转移了1mol电子,则反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
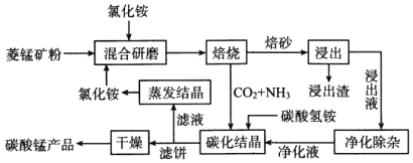
已知:①“焙烧”时发生的主要反应的化学方程式为MnCO3+2 NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O
MnCl2+2NH3↑+CO2↑+H2O
②菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
③相关金属离子[c(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
④常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11。回答下列问题:
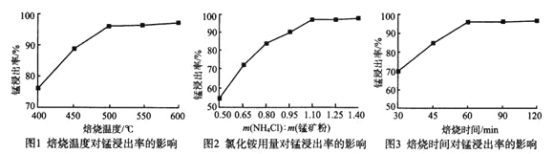
(1)分析下列图1、图2、图3,氯化铵焙烧菱锰矿的最佳条件是:___________。
(2)浸出液“净化除杂”过程如下:①加入MnO2。用离子方程式表示MnO2的作用___________;
②调节溶液的pH,除去Fe3+、Al3+。溶液恰当的pH范围为___________;
③加入NH4F将Ca2+、Mg2+除去,两种沉淀共存时溶液中c(Ca2+)=1×10-5mol·L-1,则c(Mg2+)=___________。
(3)碳化结晶过程中发生反应的离子方程式为______________________。
(4)将制得的高纯度碳酸锰溶于过量稀硫酸后用惰性电极电解,可以得到重要的无机功能材料MnO2,该电极的电极反应式为______________________。
(5)25℃时,向0 .1mol/L NH3·H2O溶液中通入HC1气体,溶液中![]() 与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是___________。
与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是___________。

A.C点的溶液中:c(NH3·H2O)>c(NH4+)
B.NH3·H2O的Kb=1.0×10-4.7
C.pOH=3的溶液中:c(NH4+)+c(H+) +c(NH3·H2O)=0.1mol/L+c(OH-)
D.pOH=7的溶液中的溶质是NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室中常见的气体制备、干燥和性质实验的部分仪器。

请回答下列问题:
(1)若实验室用大理石和稀盐酸反应制取并收集一瓶干燥的二氧化碳。
①所选仪器的连接顺序为______________________________(填写仪器序号字母)。
②生成二氧化碳的化学方程式为:____________________________。
(2)现有一混合气体,其主要成分为CO,含有少量水蒸气,还可能含有少量HCl气体。某化学课题组的同学欲用该混合气体进行实验:①检验HCl气体是否存在,并除去HCl气体②用干燥纯净的CO气体还原不纯的氧化铜试样(其中的杂质不发生变化)③检验CO气体还原氧化铜生成的气体生成物的性质。试用如图所示的仪器组装一套实验装置,完成上述实验任务。
①实验进行时,若要气体从左向右流动,则这几种仪器组件的连接顺序应是(填写仪器装置):_________。
②判定HCl气体是否存在的根据是___________________。
③若反应进行完全后,若仪器E中物质增重a g,则仪器D中的试样质量减少____g。
④若原混合气体中混有二氧化碳,反应进行完全后,若通过仪器E中物质增重来计算样品中氧化铜的纯度,测算结果将____(填“偏小”“偏大”“不受影响”之一)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用乙醇、乙酸和浓硫酸制备乙酸乙酯,分别设计了甲、乙两套装置。按图连接好装置,添加试剂后用酒精灯对左边试管小火加热3~5min后,改用大火加热,当观察到右边试管中有明显现象时停止实验。已知:乙酸乙酯的沸点为77°C,乙醇的沸点为78.5°C,乙酸的沸点为117.9°C。

(1)写出甲装置左边试管中主要发生的反应的化学方程式:______。
(2)加入的浓硫酸作用为____,装置乙中球形干燥管的作用是_____。
(3)反应开始时用酒精灯对左边试管小火加热的原因是________。
(4)停止加热后,振荡a、b两试管发现油状液体层变薄,其主要原因可能是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己二酸是合成尼龙66的重要原料。以环己烯为原料,可以与多种氧化剂反应得到己二酸(反应均在一定条件下进行)。下列氧化剂中可以称为绿色化学试剂的是( )
A.高锰酸钾B.过氧化氢C.硝酸D.重铬酸钾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com