
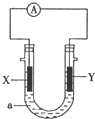
 如图:X为单质硅,Y为金属铁,a为NaOH溶液,按图组装一个原电池,下列说法正确的是( )
如图:X为单质硅,Y为金属铁,a为NaOH溶液,按图组装一个原电池,下列说法正确的是( )| A、X为负极,电极反应为:Si-4e-?Si4+ | B、X为正极,电极反应为:4H2O+4e-?4OH-+2H2↑ | C、X为负极,电极反应为:Si+6OH--4e-?SiO32-+3H2O | D、Y为负极,电极反应为:Fe-2e-?Fe2+ |


科目:高中化学 来源: 题型:
 (2012?泰州二模)已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于原子晶体;在元素周期表中Z元素位于第10列.
(2012?泰州二模)已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于原子晶体;在元素周期表中Z元素位于第10列.查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省龙岩市高三毕业班教学质量检查理综化学试卷(解析版) 题型:填空题
I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等。按要求回答下列问题:

(1)写出X的原子结构示意图_______________。
(2)列举一个事实说明W非金属性强于Z: _______________(用化学方程式表示)。
(3)含Y的某种盐常用作净水剂,其净水原理是__________(用离子方程式表示)。
II.运用所学化学原理,解决下列问题:
(4)已知:Si+2NaOH+H2O=Na2SiO3+2H2。某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为_________________。
(5)已知:①C(s)+ O2(g)=CO2(g)?  H=a kJ· mol-1;②CO2(g) +C(s)=2CO(g)
H=a kJ· mol-1;②CO2(g) +C(s)=2CO(g)  H=b kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)?
H=b kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)?  H=c kJ· mol-1。工业上生产粗硅的热化学方程式为____________。
H=c kJ· mol-1。工业上生产粗硅的热化学方程式为____________。
(6)已知:CO(g)+H2O(g) H2(g) + CO2(g)。右表为该反应在不同温度时的平衡常数。则:该反应的
H2(g) + CO2(g)。右表为该反应在不同温度时的平衡常数。则:该反应的 H________0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为_________。
H________0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为_________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com