
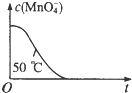
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol?L-1 | 体积/mL | 浓度/mol?L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
| 0.010mol/L×0.004L |
| 0.002L+0.004L |
| 2 |
| 3 |
| ||
|
 ,故答案为:
,故答案为: .
.


科目:高中化学 来源: 题型:
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入AgNO3溶液有白色沉淀生成,证明原溶液中一定有大量Cl- |
| B、加入硝酸后的溶液中,滴加BaCl2溶液,有白色沉淀生成,证明原溶液中一定有大量SO42- |
| C、加入盐酸后,放出能使澄清石灰水变浑浊的无色气体,证明原溶液中一定含有大量CO32- |
| D、加入无色酚酞试液后,溶液显红色,证明原溶液中一定含有大量OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
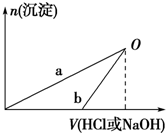 某同学研究铝及其化合物的性质时设计了如下两个实验方案.
某同学研究铝及其化合物的性质时设计了如下两个实验方案.| 100mL稀盐酸 |
| NaOH溶液 |
| 100mLNaOH溶液 |
| 稀盐酸 |
| A、在O点时两方案中所得溶液的溶质物质的量相等 |
| B、b曲线表示的是向X溶液中加入NaOH溶液 |
| C、X溶液溶质为AlCl3,Y溶液溶质为NaAlO2 |
| D、a、b曲线表示的反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C CuO FeO |
| B、(NH4)2SO4 K2SO4 NH4Cl |
| C、Na2CO3 NaHCO3 K2CO3 |
| D、AgNO3 KNO3 Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
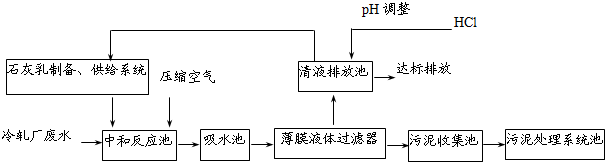
| 冷轧含锌废水水质 | 经处理后的水国家环保标准值 | |
| Zn2+浓度/(mg?L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~9 |
| SO42-浓度/(mg?L-1) | ≤23 000 | ≤150 |
查看答案和解析>>
科目:高中化学 来源: 题型:
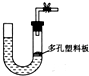
| A、大理石和稀硫酸制取二氧化碳 |
| B、锌粒和稀硫酸制氢气 |
| C、浓盐酸和二氧化锰制取氯气 |
| D、过氧化钠和水制取氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
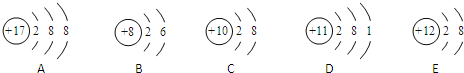
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com