
| A. | 温度升高,Na2CO3溶液中各种离子的浓度均增大 | |
| B. | 沉淀转化的离子方程式为CO32-(aq)+CaSO4(s)?CaCO3(s)+SO42-(aq) | |
| C. | 该条件下CaCO3的溶解度约为1×10-3g | |
| D. | CaCO3和CaSO4共存的体系中,一定有$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=9×104 |
分析 A.升高温度,促进水解,碱性增强;
B.由Ksp可知,CaCO3更难溶;
C.结合c(CO32-)=c(Ca2+)=$\sqrt{Ksp}$计算;
D.CaCO3和CaSO4共存的体系中,$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=$\frac{\sqrt{Ksp(CaS{O}_{4})}}{\sqrt{Ksp(CaC{O}_{3})}}$.
解答 解:A.升高温度,促进水解,碱性增强,Na2CO3溶液中钠离子浓度不变,氢离子浓度减小,其它离子浓度增大,故A错误;
B.由Ksp可知,CaCO3更难溶,沉淀转化的离子方程式为CO32-(aq)+CaSO4(s)?CaCO3(s)+SO42-(aq),故B正确;
C.由c(CO32-)=c(Ca2+)=$\sqrt{Ksp}$=$\sqrt{1×1{0}^{-10}}$=10-5mol/L,设溶液为1L,则$\frac{S}{100}$=$\frac{1{0}^{-5}mol×100g/mol}{1000g}$,解得S=10-4g,该条件下CaCO3的溶解度约为1×10-4g,故C错误;
D.CaCO3和CaSO4共存的体系中,$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=$\frac{\sqrt{Ksp(CaS{O}_{4})}}{\sqrt{Ksp(CaC{O}_{3})}}$=$\frac{1×1{0}^{-6}}{1×1{0}^{-10}}$=104,故D错误;
故选B.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握溶解平衡移动、Ksp的计算、沉淀转化为解答的关键,侧重分析与应用能力的考查,注意选项C中溶解度的计算为解答的难点,题目难度不大.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:解答题
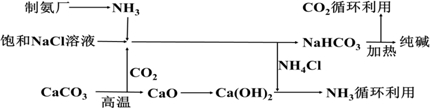
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在t℃时,AgBr的Ksp为4.9×10-13 | |
| B. | 在t℃时,AgCl(s)+Br-(aq)═AgBr(s)+Cl-(aq)的平衡常数 K≈816 | |
| C. | 图中a点对应的是AgBr的不饱和溶液 | |
| D. | 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
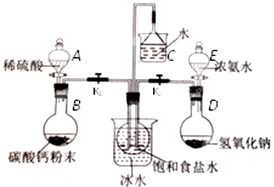
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/oC | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
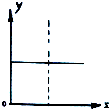
| A. | N2(g)+3H2(g)?2NH3(g),恒容条件下达到平衡后充入He,N2的转化率与时间的关系 | |
| B. | CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0,平衡后CH4的物质的量与△H的关系 | |
| C. | FeCl3+3KSCN?Fe(SCN)3+3KCl,平衡后加入KCl固体,c(Cl-)与正反应速率关系 | |
| D. | H2(g)+I2(g)?2HI(g),平衡后缩小容器容积,速率与时间的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数与中子数相等的硫原子:${\;}_{16}^{32}$S | |
| B. | Al3+的结构示意图: | |
| C. | CaO2的电子式: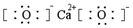 | |
| D. | 2-溴丙烷的结构简式:C3H7Br |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com