
| 温度/oC | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
分析 (1)已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H=-1266.8kJ/mol;②N2(g)+O2(g)=2NO(g);△H=+180.5kJ/mol,利用盖斯定律可求知反应热;
(2)氨气为碱性气体,易与酸反应,应用碱性电解质,负极发生氧化反应;
(3)①依据升高温度平衡常数减小,据此判断反应的热效应确定a值;
②为了增大平衡时H2的转化率,平衡正向进行,依据勒沙特列原理分析选项解答;
③依据浓度商Qc和平衡常数K比较判断反应进行的方向;
(4)①溶液中离子浓度关系满足c(NH4+)>c(Cl-)时,由电荷守恒可知c(H+)<c(OH-),溶液呈碱性,结合选项根据反应物量的关系,判断溶液酸碱性;
②根据电荷守恒判断溶液中氢离子与氢氧根离子浓度的相对大小,进而判断溶液的酸碱性;
溶液中存在平衡NH3.H2O?NH4++OH-,根据溶液的pH值计算溶液中c(OH-),根据氯离子浓度计算c(NH4+),利用物料守恒计算溶液中c(NH3.H2O),代入NH3•H2O的电离常数表达式计算.
解答 解:(1):①4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1266.8kJ/mol,
②N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol,
利用盖斯定律①-2×②可得:4NH3(g)+5O2(g) $\frac{\underline{\;催化剂\;}}{△}$4NO(g)+6H2O(g);△H=-905.8KJ/mol;
故答案为:4NH3(g)+5O2(g) $\frac{\underline{\;催化剂\;}}{△}$4NO(g)+6H2O(g);△H=-905.8KJ/mol;
(2)氨气为碱性气体,易与酸反应,所以电解质溶液应呈碱性,负极发生氧化反应,氨气被氧化生产氮气,电极反应式为2NH3-6e-+6OH-=N2+6H2O,
故答案为:碱性;2NH3-6e-+6OH-=N2+6H2O;
(3)①依据图中数据可知,温度升高,反应的化学平衡常数减小,平衡逆向移动,则正反应为放热反应,所以a<0;
故答案为:<;
②反应是N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,反应是气体体积减小的放热反应,为了增大平衡时H2的转化率,平衡正向进行分析,
a.增大压强,平衡正向进行,氢气转化率增大,故a符合;
b.使用合适的催化剂,改变反应速率,不能改变平衡,氢气转化率不变,故b不符合;
c.升高温度平衡逆向进行,氢气转化率减小,故c不符合;
d.及时分离出产物中的NH3,平衡正向进行,氢气转化率增大,故d符合;
故答案为:ad;
③400oC时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol,则氨气、氮气、氢气的物质的量浓度分别为:6mol•L-1、4mol•L-1、2mol•L-1时,Qc=$\frac{{6}^{2}}{2×{1}^{3}}$=18>K=0.5,说明反应向逆反应方向进行,因此v正(N2)<v逆(N2),
故答案为:<;
(4)①溶液中离子浓度关系满足c(NH4+)>c(Cl-)时,由电荷守恒可知c(H+)<c(OH-),溶液呈碱性,
a.盐酸不足,氨水剩余,反应后溶液为氯化铵和一水合氨混合物,溶液可能显碱性,故a选;
b.氨水与盐酸恰好完全反应生成氯化铵,氯化铵为强酸弱碱盐,水解显酸性,故b不选;
c.盐酸过量反应生成氯化铵和盐酸,溶液显酸性,故c不选;
故选:a;
②根据电荷守恒有c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于c(NH4+)=c(Cl-),故c(H+)=c(OH-),溶液呈中性,故溶液中c(OH-)=10-7mol/L,溶液中c(NH4+)=c(Cl-)=$\frac{1}{2}$×0.1mol•L-1=0.05mol•L-1,故混合后溶液中c(NH3.H2O)=$\frac{1}{2}$×amol•L-1-0.05mol•L-1=(0.5a-0.05)mol/L,NH3•H2O的电离常数Kb=$\frac{1{0}^{-7}×0.05}{0.5a-0.05}$=$\frac{1{0}^{-8}}{a-0.1}$,
故答案为:$\frac{1{0}^{-8}}{a-0.1}$.
点评 本题考查了反应热的计算、燃料电池电极反应式的书写、化学平衡问题、浓度熵与平衡常数计算,综合性很强,明确盖斯定律计算反应的方法,熟悉原电池工作原理,化学平衡理论是解题关键,题目难度较大.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 在空气中,金属银的表面生成一层黑色物质 | |
| B. | 镀银的铁制品,镀层部分受损后,露出的铁表面易被腐蚀 | |
| C. | 埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀 | |
| D. | 为保护海轮的船壳,常在船壳上镶入锌块 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度升高,Na2CO3溶液中各种离子的浓度均增大 | |
| B. | 沉淀转化的离子方程式为CO32-(aq)+CaSO4(s)?CaCO3(s)+SO42-(aq) | |
| C. | 该条件下CaCO3的溶解度约为1×10-3g | |
| D. | CaCO3和CaSO4共存的体系中,一定有$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=9×104 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 容器 | 1 | 2 | 3 | 4 |
| 反应物投入量 (始态) | 1mol CO2 3mol H2 | 1mol CH3OH 1mol H2O | 2mol CH3OH 2mol H2O | 0.8mol CO2 2.4mol H2 0.2mol CH3OH 0.2mol H2O |
| CH3OH的平衡浓度/mol•L-1 | c1 | c2 | c3 | c4 |
| 反应的能量变化 | 放出 x kJ | 吸收y kJ | 吸收z kJ | 放出 w kJ |
| 体系压强/Pa | p1 | p2 | p3 | p4 |
| 反应物转化率 | a1 | a2 | a3 | a4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向5mL 0.4mol•L-1 NaOH溶液中先加入3滴1mol•L-1MgCl2溶液,再加入3滴1mol•L-1FeCl3溶液,能证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | |
| B. | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成,说明淀粉没有水解成葡萄糖 | |
| C. | 用某已知浓度的HCl 滴定未知浓度的NaOH,滴定前尖嘴有气泡滴定终点气泡消失,则测定所得NaOH的浓度偏低 | |
| D. | 向氯水中滴加AgNO3、稀HNO3溶液,若产生白色沉淀,则说明氯水中含有氯离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
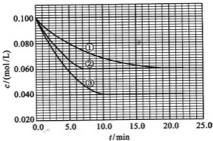 在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.
在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ③⑤ | C. | ①②④ | D. | ①③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com