
| A. | 向5mL 0.4mol•L-1 NaOH溶液中先加入3滴1mol•L-1MgCl2溶液,再加入3滴1mol•L-1FeCl3溶液,能证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | |
| B. | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成,说明淀粉没有水解成葡萄糖 | |
| C. | 用某已知浓度的HCl 滴定未知浓度的NaOH,滴定前尖嘴有气泡滴定终点气泡消失,则测定所得NaOH的浓度偏低 | |
| D. | 向氯水中滴加AgNO3、稀HNO3溶液,若产生白色沉淀,则说明氯水中含有氯离子 |
分析 A.NaOH过量,不能发生沉淀的转化;
B.水解后检验葡萄糖,应在碱性条件下;
C.滴定前尖嘴有气泡滴定终点气泡消失,则消耗的盐酸偏大,结合c(NaOH)=$\frac{c(盐酸)V(盐酸)}{V(NaOH)}$分析;
D.滴加AgNO3、稀HNO3溶液,若产生白色沉淀,白色沉淀为AgCl.
解答 解:A.NaOH过量,不能发生沉淀的转化,则不能证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀,应利用沉淀的转化比较Ksp,故A错误;
B.向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后加碱至碱性,再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成,说明淀粉没有水解成葡萄糖,故B错误;
C.滴定前尖嘴有气泡滴定终点气泡消失,则消耗的盐酸偏大,由c(NaOH)=$\frac{c(盐酸)V(盐酸)}{V(NaOH)}$可知,测定所得NaOH的浓度偏高,故C错误;
D.滴加AgNO3、稀HNO3溶液,若产生白色沉淀,白色沉淀为AgCl,可知氯水中含有氯离子,故D正确;
故选D.
点评 本题考查难溶电解质的溶解平衡、中和滴定、有机物的性质,为高频考点,把握沉淀的生成、有机物的检验、中和滴定、离子检验为解答的关键,侧重分析与应用能力的考查,注意选项A为易错点,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 单质--铝 石墨 氮气 | |
| B. | 混合物--空气 粗盐 牛奶 | |
| C. | 碱--烧碱 纯碱 熟石灰 | |
| D. | 氧化物--氧化铜 二氧化锰 二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

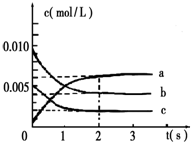
| A. | 在t℃时,AgBr的Ksp为4.9×10-13 | |
| B. | 在t℃时,AgCl(s)+Br-(aq)═AgBr(s)+Cl-(aq)的平衡常数 K≈816 | |
| C. | 图中a点对应的是AgBr的不饱和溶液 | |
| D. | 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/oC | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
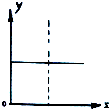
| A. | N2(g)+3H2(g)?2NH3(g),恒容条件下达到平衡后充入He,N2的转化率与时间的关系 | |
| B. | CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0,平衡后CH4的物质的量与△H的关系 | |
| C. | FeCl3+3KSCN?Fe(SCN)3+3KCl,平衡后加入KCl固体,c(Cl-)与正反应速率关系 | |
| D. | H2(g)+I2(g)?2HI(g),平衡后缩小容器容积,速率与时间的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
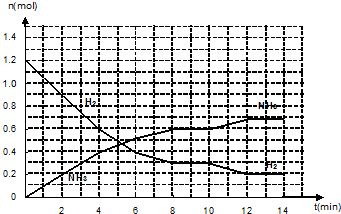
 氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.
氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
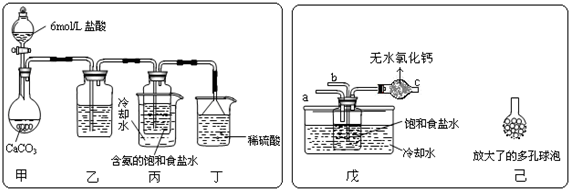
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,可用焦炭和石英砂(SiO2)制取高纯度硅 | |
| B. | CO2和钠在一定条件下可以得到金刚石和碳酸钠,反应中氧化剂和还原剂之比是4:1 | |
| C. | 用高纯度硅作为光导纤维的主要材料 | |
| D. | 现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,其主要成分是NH4Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com