
| A. | 高温下,可用焦炭和石英砂(SiO2)制取高纯度硅 | |
| B. | CO2和钠在一定条件下可以得到金刚石和碳酸钠,反应中氧化剂和还原剂之比是4:1 | |
| C. | 用高纯度硅作为光导纤维的主要材料 | |
| D. | 现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,其主要成分是NH4Cl |
分析 A.焦炭和石英砂(SiO2)制粗硅;
B.化合价升高和降低的总数相等;
C.光导纤维的主要成分是二氧化硅;
D.SiCl4(极易水解)水解后生成硅酸和氯化氢.
解答 解:A.焦炭和石英砂(SiO2)制粗硅,而不是高纯度的硅,故A错误;
B.CO2和钠在一定条件下反应可以得到金刚石和碳酸钠,反应中氧化剂和还原剂的物质的量之比是1:4,故B错误;
C.光导纤维的主要成分是二氧化硅,而不是硅,故C错误;
D.SiCl4(极易水解)水解后生成硅酸和氯化氢,氯化氢易和氨气反应生成氯化铵固体,故D正确.
故选D.
点评 本题考查硅的化合物的性质,难度中等,注意SiCl4(极易水解)水解后生成硅酸和氯化氢,氯化氢易和氨气反应生成氯化铵固体.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 向5mL 0.4mol•L-1 NaOH溶液中先加入3滴1mol•L-1MgCl2溶液,再加入3滴1mol•L-1FeCl3溶液,能证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | |
| B. | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成,说明淀粉没有水解成葡萄糖 | |
| C. | 用某已知浓度的HCl 滴定未知浓度的NaOH,滴定前尖嘴有气泡滴定终点气泡消失,则测定所得NaOH的浓度偏低 | |
| D. | 向氯水中滴加AgNO3、稀HNO3溶液,若产生白色沉淀,则说明氯水中含有氯离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
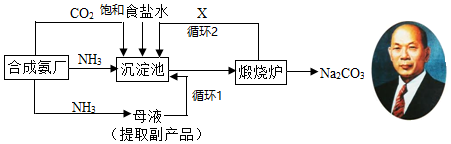
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ③⑤ | C. | ①②④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 =2Cr(OH)3↓+3O2↑+2H2O.
=2Cr(OH)3↓+3O2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
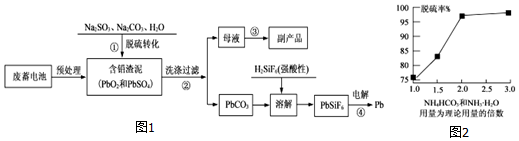
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
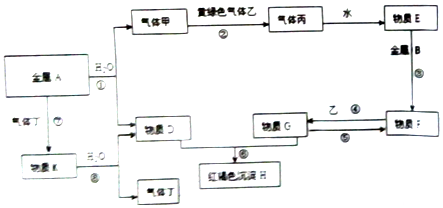
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
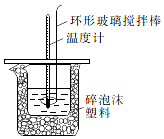 某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.8 | 6.8 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com