
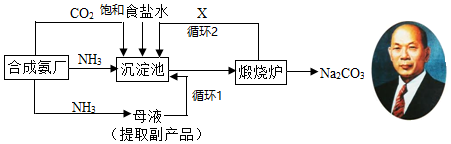
���� �����̿�֪���ϳɰ��ṩ�������������̼��ʳ��ˮ��Ӧ����NH4Cl��NaHCO3���ڳ������й��˷����̼�����ƣ�̼�����Ʒֽ�����̼���ơ�ˮ��������̼��XΪ������̼����ѭ��ʹ�ã�ĸҺ�к��Ȼ�泥�
��1������ʳ��ˮ��ͨ�백���Ͷ�����̼����̼�����ƾ��壬������������̼��ˮ���Ȼ��Ʒ�����Ӧ����̼�����ƺ��Ȼ�泥�ʵ�ֳ�������Һ�ķ�����ù��˵ķ��������ݹ��˲���ѡ����������
��2������¯�ڷֽ����̼�����ƣ�����ΪCO2��ˮ��������������Ҫͨ�������ΪCO2��
��3��ѭ�����е��Ȼ������ַ��ص������أ�
��4���μ�ϡ�������������Һ���������ӣ�
��5����������ˮ�����ɰ�ˮ����ˮ�����笠�������笠���Ũ���������Ȼ�淋�������������ͬʱͨ�백��ʹ��Һ������ǿ��ʹ̼������ת��Ϊ�ܽ�Ƚϴ��̼���ƣ���������Ȼ�淋Ĵ��ȣ�
��� �⣺��1���������У�����ʳ��ˮ��ͨ�백���Ͷ�����̼����̼�����ƾ��壬��Ӧ����ʽΪ��NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3���������ǽ����岻�����Һ������һ�ַ�����������Ҫ�������У��ձ���������������̨��©�����ձ�����ʢ��Һ�壬©�����ڹ��ˣ����������������ͽ��裬���Ըò���ʹ�õIJ��������У�©�����ձ�����������
�ʴ�Ϊ��NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3����©�����ձ�����������
��2��̼���������ȷֽ�����̼���ơ�CO2��ˮ���ɽ�CO2ͨ�������ѭ�����ã���XΪCO2��
�ʴ�Ϊ��CO2��
��3��ѭ�����ǽ�δ��Ӧ���Ȼ��Ʒ��س������У�
�ʴ�Ϊ��ѭ����
��4�������Ʒ̼�������Ƿ����Ȼ��Ƽ������Ƿ������ӣ������������ữ�����������۲쵽��������ɫ������˵�����Ȼ��ƴ��ڣ�
�ʴ�Ϊ���μ�ϡ�������������Һ��
��5��A����������ˮ�����ɰ�ˮ����ˮ�����笠�������笠���Ũ���������Ȼ�淋�����������A��ȷ��
B��ͨ�백��ʹ��Һ������ǿ��ʹ̼������ת��Ϊ�ܽ�Ƚϴ��̼���ƣ�����ʹNaHCO3�������������B����
C��ͨ�백��ʹ��Һ������ǿ��ʹ̼������ת��Ϊ�ܽ�Ƚϴ��̼���ƣ���������Ȼ�淋Ĵ��ȣ���C��ȷ��
�ʴ�Ϊ��AC��
���� ���⿼�鴿�ҵ��Ϊ��Ƶ���㣬�����Ʊ���ҵ���̡����������ᴿΪ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע�����ʵ�ѭ��ʹ�ã���Ŀ�Ѷ��еȣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ��t��ʱ��AgBr��KspΪ4.9��10-13 | |
| B�� | ��t��ʱ��AgCl��s��+Br-��aq���TAgBr��s��+Cl-��aq����ƽ�ⳣ�� K��816 | |
| C�� | ͼ��a���Ӧ����AgBr�IJ�������Һ | |
| D�� | ��AgBr������Һ�м���NaBr���壬��ʹ��Һ��c��䵽b�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
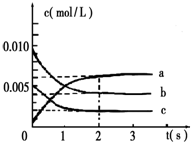 ���Ǵ����к����������壬�о������仯�������������Ҫ�����壮
���Ǵ����к����������壬�о������仯�������������Ҫ�����壮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
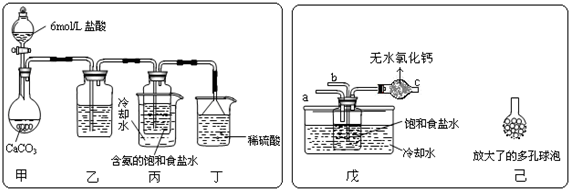
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���е��Ȼ�ѧ����ʽΪ2C��g��?A��g��+3B��g������H=+4Q2/3kJ/mol | |
| B�� | ��Ӧ�ﵽƽ��ǰ������ʼ����v������v��������ʼ����v������v�� | |
| C�� | �ڸ������£���Ӧ2C��g��?A��g��+3B��g����ƽ�ⳣ��Ϊ9��1.52��mol/L��2 | |
| D�� | ����C��ת����Ϊ25% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������������ȵ���ԭ�ӣ�${\;}_{16}^{32}$S | |
| B�� | Al3+�Ľṹʾ��ͼ�� | |
| C�� | CaO2�ĵ���ʽ��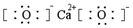 | |
| D�� | 2-�����Ľṹ��ʽ��C3H7Br |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̼��������ᷴӦ��CO32-+2H+=H2O+CO2�� | |
| B�� | ϡH2SO4�����۷�Ӧ��2Fe+6H+=2Fe3++3H2�� | |
| C�� | ����������Һ��ϡH2SO4��Ӧ��Ba2++SO42-=BaSO4�� | |
| D�� | ��������������������Fe��OH��3+3H+=Fe3++3H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����£����ý�̿��ʯӢɰ��SiO2����ȡ�ߴ��ȹ� | |
| B�� | CO2������һ�������¿��Եõ����ʯ��̼���ƣ���Ӧ���������ͻ�ԭ��֮����4��1 | |
| C�� | �øߴ��ȹ���Ϊ���ά����Ҫ���� | |
| D�� | �ִ���սͨ�����Һ��SiCl4������ˮ�⣩��Һ���ɲ�����Ļ������Ҫ�ɷ���NH4Cl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| T/min | n��X��/mol | n��Y��/mol | n��Z��/mol |
| 0 | 0.80 | 1.00 | 0 |
| 1 | 0.70 | 0.80 | |
| 5 | 0.70 | ||
| 9 | 0.40 | ||
| 10 | 0.40 | 0.80 |

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com