
| A. | 乙中的热化学方程式为2C(g)?A(g)+3B(g);△H=+4Q2/3kJ/mol | |
| B. | 反应达到平衡前,甲中始终有v正大于v逆,乙中始终有v正大于v逆 | |
| C. | 在该条件下,反应2C(g)?A(g)+3B(g)的平衡常数为9×1.52(mol/L)2 | |
| D. | 乙中C的转化率为25% |
分析 A、可逆反应不能完全反应,2molC分解吸收的热量大于Q2kJ;
B、甲中反应正向进行建立平衡,乙中逆向进行建立平衡;
C、由A分析可知平衡时乙中C为0.5mol,故:
2C(g)?A(g)+3B(g)
起始量(mol):2 0 0
变化量(mol):1.5 0.75 2.25
平衡量(mol):0.5 0.75 2.25
再根据K=$\frac{c(A)×{c}^{3}(B)}{{c}^{2}(C)}$计算平衡常数;
D、甲容器中开始加入1molA的和3molB与乙容器中开始加入2mol C为完全等效平衡,平衡时相同组分的物质的量相等,设甲中平衡时C为xmol,则乙中反应的C为(2-x)mol,由于Q2=3Q1,则(2-x)mol=3xmol,解得x=0.5,进而计算乙中C的转化率;
解答 解:A、可逆反应不能完全反应,2molC分解吸收的热量大于Q2kJ,甲容器中开始加入1molA的和3molB与乙容器中开始加入2mol C为完全等效平衡,平衡时相同组分的物质的量相等,设甲中平衡时C为xmol,则乙中反应的C为(2-x)mol,由于Q2=3Q1,则(2-x)mol=3xmol,解得x=0.5,故乙中C的转化率为$\frac{(2-0.5)mol}{2mol}$×100%=75%,2molC完全分解吸收的热量为Q2kJ×$\frac{2mol}{1.5mol}$=$\frac{4}{3}$Q2kJ,反应热化学方程式为:2C(g)?A(g)+3B(g),△H=+$\frac{4}{3}$Q2kJ/mol,故A正确;
B、甲中反应正向进行建立平衡,乙中逆向进行建立平衡,故反应达到平衡前,甲中始终有v正大于v逆,乙中始终有v正小于v逆,故B错误;
C、由A分析可知平衡时乙中C为0.5mol,故:
2C(g)?A(g)+3B(g)
起始量(mol):2 0 0
变化量(mol):1.5 0.75 2.25
平衡量(mol):0.5 0.75 2.25
故平衡常数K=$\frac{c(A)×{c}^{3}(B)}{{c}^{2}(C)}$=$\frac{0.75×(2.25)^{3}}{0.{5}^{2}}$(mol/L)2=27×1.54(mol/L)2,故C错误;
D、甲容器中开始加入1molA的和3molB与乙容器中开始加入2mol C为完全等效平衡,平衡时相同组分的物质的量相等,设甲中平衡时C为xmol,则乙中反应的C为(2-x)mol,由于Q2=3Q1,则(2-x)mol=3xmol,解得x=0.5,故乙中C的转化率为$\frac{(2-0.5)mol}{2mol}$×100%=75%,故D错误;
故选A.
点评 本题考查了化学平衡的计算、化学平衡建立、化学平衡常数等,题目难度中等,关键是等效平衡的应用,旨在培养学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:解答题
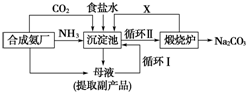
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知某温度下纯水中的c(H+)=2×l0-7mol/L,据此无法求出水中c(OH-) | |||||||||
| B. | 已知Ksp(AgCl)>Ksp(AgBr),将AgCl和AgBr的饱和溶液等体积混合,再加入足量浓的AgNO3溶液,则最先析出AgBr沉淀并且其沉淀量多于AgCl沉淀 | |||||||||
| C. | 反应A(g)?2B(g)△H若正反应的活化能为Ea kJ•mol-1,逆反应的活化能为Eb kJ•mol-1,则△H=Ea-Eb kJ•mol-1 | |||||||||
| D. | 已知:
|
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
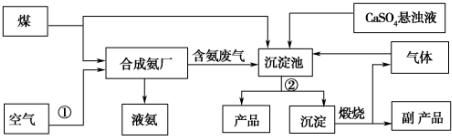
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A气体是NH3 | |
| B. | 悬浊液的离子主要有Na+、NH4+、Cl-、HCO3- | |
| C. | 第Ⅲ步操为过滤 | |
| D. | 第Ⅳ步操作所使用的仪器主要有铁架台、酒精灯、蒸发皿、玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
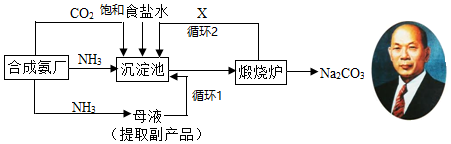
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
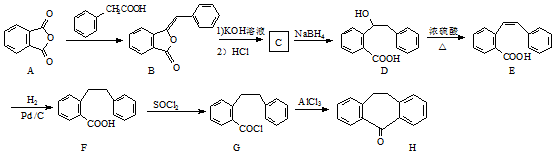
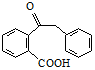 .
.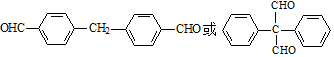 .
.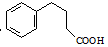 为原料制备
为原料制备 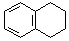 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 =2Cr(OH)3↓+3O2↑+2H2O.
=2Cr(OH)3↓+3O2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
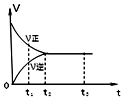
| A. | t1时,只有正方向反应 | |
| B. | t2-t3,反应不再发生 | |
| C. | t2-t3,各物质的浓度均没有发生变化 | |
| D. | t2时,反应到达限度,正反应和逆反应速率相等且等于零 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com