
| A. | 已知某温度下纯水中的c(H+)=2×l0-7mol/L,据此无法求出水中c(OH-) | |||||||||
| B. | 已知Ksp(AgCl)>Ksp(AgBr),将AgCl和AgBr的饱和溶液等体积混合,再加入足量浓的AgNO3溶液,则最先析出AgBr沉淀并且其沉淀量多于AgCl沉淀 | |||||||||
| C. | 反应A(g)?2B(g)△H若正反应的活化能为Ea kJ•mol-1,逆反应的活化能为Eb kJ•mol-1,则△H=Ea-Eb kJ•mol-1 | |||||||||
| D. | 已知:
|
分析 A.纯水中的c(H+)=c(OH-);
B.Ksp(AgCl)>Ksp(AgBr),将AgCl和AgBr的饱和溶液等体积混合时,Ksp小的先沉淀,但硝酸银足量,c(Cl-)大;
C.焓变等于正逆反应的活化能之差;
D.发生H2+Br2=2HBr△H<0,焓变等于反应物中键能之和减去生成物中键能之和.
解答 解:A.已知某温度下纯水中的c(H+)=2×l0-7mol/L,据此可知水中c(OH-)=2×l0-7mol/L,故A错误;
B.由Ksp(AgCl)>Ksp(AgBr),将AgCl和AgBr的饱和溶液等体积混合,c(Cl-)大,再加入足量浓的AgNO3溶液,则最先析出AgBr沉淀,但其沉淀量小于AgCl沉淀,故B错误;
C.焓变等于正逆反应的活化能之差,若正反应的活化能为Ea kJ•mol-1,逆反应的活化能为Eb kJ•mol-1,则△H=Ea-Eb kJ•mol-1,故C正确;
D.发生H2+Br2=2HBr△H<0,则Q1+Q2-2Q3<0,可知Q1+Q2<2Q3,故D错误;
故选C.
点评 本题考查难溶电解质的溶解平衡及反应热与焓变,为高频考点,把握Ksp的应用、焓变的计算为解答的关键,侧重分析与应用能力的考查,注意选项B为易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 若2CH3OH(1)+3O2(g)═2CO2(g)+2H2O(g)△H=-1478KJ/mol,则CH3OH(1)的燃烧热为739KJ/mol | |
| B. | 若P4(白磷,s)═4P(红磷,s)△H<0,则红磷比白磷稳定 | |
| C. | 已知H+(aq)+OH-(aq)═H2O(1)△H=-57.3KJ/mol,则20.0g NaOH固体与稀盐酸完全中和,放出28.65KJ的热量 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1; 2C(s)+O2(g)=2CO(g)△H2;△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当混合气体的质量不变,说明反应已达平衡状态 | |
| B. | 缩小容器体积,重新达到平衡时,气体混合物中C%可能增大 | |
| C. | 在恒压容器中升高温度,气体混合物中C%可能先增大后减小 | |
| D. | 在恒容容器中升高温度,达到新平衡时,气体的密度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
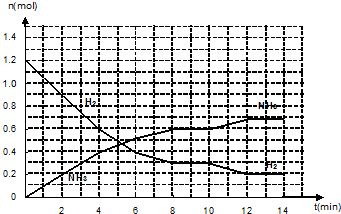
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
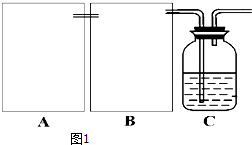
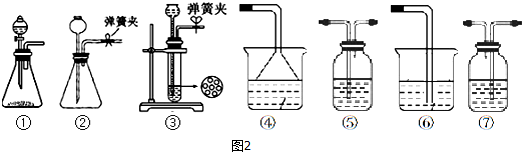
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
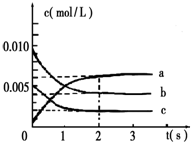 氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.
氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 氨碱法 | 联合制碱法 | ||
| A. | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
| B. | 副产物 | 氯化钙 | 氯化铵 |
| C. | 循环物质 | 氨气、二氧化碳 | 氯化钠 |
| D. | 评价 | 原料易得;设备复杂;能耗高 | 原料利用率高;废弃物少 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙中的热化学方程式为2C(g)?A(g)+3B(g);△H=+4Q2/3kJ/mol | |
| B. | 反应达到平衡前,甲中始终有v正大于v逆,乙中始终有v正大于v逆 | |
| C. | 在该条件下,反应2C(g)?A(g)+3B(g)的平衡常数为9×1.52(mol/L)2 | |
| D. | 乙中C的转化率为25% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com