
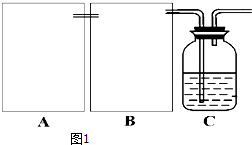
���� ��1����CO2ʱΪ��ʹ��Ӧ�濪���ã������ͣ����ҪӦ�����շ�������װ��ԭ��������ֹˮ�п�������ѹǿ��ʹҺ��������ֹͣ��Ӧ����ѹǿ��СҺ�����Ӵ�������Ӧ��
��2���Ʊ���������̼�����к����Ȼ������壬Ӱ��̼�����Ƶ����ɣ�Bװ������Ҫͨ������̼��������Һ��ȥ����Bװ��Ϊϴ��װ�ã�
��3�����ͷ�Ӧ���¶ȣ�̼�������ܽ�ȼ�С��
��4�����ݻ�ѧ����ʽ������������̼�����Ƶ�����������̼�����Ʒֽ�Ļ�ѧ����ʽ����̼�������������ʵ������̼���Ƶ�����������ʣ�
��� �⣺��1�����շ���������ʱ���У���ʱֹͣ��װ�ã������ڹ����Һ�岻���ȷ�Ӧ���ɲ�����ˮ�������Ʊ���Ӧ��������CO2ʱΪ��ʹ��Ӧ�濪���ã������ͣӦ�������շ�������ԭ��Ӧ�ã�Ӧ��ѡ��װ�âۣ�����ֹˮ�п�������ѹǿ���رյ��ɼк�Ӧ���ɵ�����ʹ�ϲ�ѹǿ������һ���̶Ⱥ�ɰѷ�ӦҺѹ��©����ʹҺ��������ֹͣ��Ӧ����ѹǿ��СҺ�����Ӵ�������Ӧ��
�ʴ�Ϊ���ۣ��رյ��ɼк�Ӧ���ɵ�����ʹ�ϲ�ѹǿ������һ���̶Ⱥ�ɰѷ�ӦҺѹ��©����ʹ��Һ����Ӷ�ֹͣ��Ӧ��
��2���Ʊ���������̼�����к����Ȼ������壬Ӱ��̼�����Ƶ����ɣ�Bװ������Ҫͨ������̼��������Һ��ȥ����Bװ��ϴ��װ�ã������ܳ����̳�������ѡ��ͼ�е�װ�âݣ�
�ʴ�Ϊ���ݣ�����̼��������Һ��
��3��ͨ�������¶ȣ���С̼�����Ƶ��ܽ�ȣ�ʹ̼���������������Խ�Cװ�ý�����һ��ʢ�б�ˮ������ˮ������ձ������ԴﵽĿ�ģ�
�ʴ�Ϊ����Cװ�ý�����һ��ʢ�б�ˮ������ˮ�������ձ��У���
��4�������ñ���ʳ��ˮ�к���NaCl������Ϊ5.85g�����������ݻ�ѧ����ʽ���㣺NH3+CO2+H2O+NaCl=NaHCO3+NH4Cl���õ�̼����������Ϊ$\frac{5.85}{58.5}$��84=8.4g���ֽ�����̼�����������ݻ�ѧ����ʽ���㣺2NaHCO3=Na2CO3+H2O+CO2����̼���Ƶ�����Ϊ$\frac{8.4}{84}$��$\frac{1}{2}$��106=5.3g��ʵ���õ������NaHCO3���������Ϊ5.46g������̼��������Ϊ��
2NaHCO3 $\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+H2O+CO2����
168 106
5.46g $\frac{5.46��106}{168}$=3.445g
����ڶ����ֽ�ʱû����ʧ����̼���ƵIJ���=$\frac{3.445g}{5.3g}$��100%=65%��
�ʴ�Ϊ��65%��
���� ���⿼���˴����Ʊ�ԭ����ʵ��Ӧ�ã�������һ��ʵ��̽���ۺ��⣬�����ۺ���ǿ�������ڿ���ѧ���Ի���֪ʶ���ۺ�Ӧ��������ʵ��̽����������Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1molNa2O2���������4NA������ | |
| B�� | 0.1mol AlCl3��ȫˮ��ת��Ϊ�����������壬����0.1NA������ | |
| C�� | ���³�ѹ��16gO2��O3������庬��NA����ԭ�� | |
| D�� | 1mol/LNa2CO3��Һ�к���NA��CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
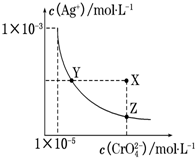 ��t��ʱ��Ag2CrO4���ٺ�ɫ����ˮ��Һ�еij����ܽ�ƽ��������ͼ��ʾ�� ��֪AgCl��Ksp=1.8��10-10������˵����ȷ���ǣ�������
��t��ʱ��Ag2CrO4���ٺ�ɫ����ˮ��Һ�еij����ܽ�ƽ��������ͼ��ʾ�� ��֪AgCl��Ksp=1.8��10-10������˵����ȷ���ǣ�������| A�� | t��ʱ��Ag2CrO4��KspΪ1��10-8 | |
| B�� | �ڱ���Ag2CrO4��Һ�м���K2CrO4��ʹ��Һ��Y���ΪX�� | |
| C�� | t��ʱ��Y���Z��ʱAg2CrO4��Ksp��� | |
| D�� | t��ʱ����0.01 mol•L-1 AgNO3��Һ����20 mL 0.01 mol•L-1 KCl��0.01 mol•L-1 K2CrO4�Ļ����Һ�У�CrO42-�ȳ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��֪ij�¶��´�ˮ�е�c��H+��=2��l0-7mol/L���ݴ������ˮ��c��OH-�� | |||||||||
| B�� | ��֪Ksp��AgCl����Ksp��AgBr������AgCl��AgBr�ı�����Һ�������ϣ��ټ�������Ũ��AgNO3��Һ������������AgBr�������������������AgCl���� | |||||||||
| C�� | ��ӦA��g��?2B��g����H������Ӧ�Ļ��ΪEa kJ•mol-1���淴Ӧ�Ļ��ΪEb kJ•mol-1�����H=Ea-Eb kJ•mol-1 | |||||||||
| D�� | ��֪��
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
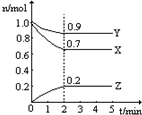 ij�¶�ʱ����һ��2L���ݵ��ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ�����ݣ�����д���пհף�
ij�¶�ʱ����һ��2L���ݵ��ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ�����ݣ�����д���пհף�| ��� | �ı������ | ����Ӧ������ |
| �� | �����¶� | |
| �� | ����Y��Ũ�� | |
| �� | ʹ�ú��ʵĴ��� | |
| �� | ����������� |
�鿴�𰸺ͽ���>>
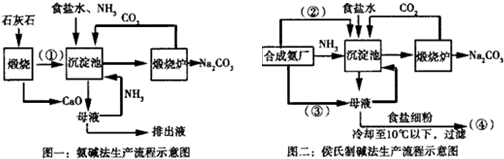
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | A������NH3 | |
| B�� | ����Һ��������Ҫ��Na+��NH4+��Cl-��HCO3- | |
| C�� | �ڢ�Ϊ���� | |
| D�� | �ڢ���������ʹ�õ�������Ҫ������̨���ƾ��ơ����������� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com