
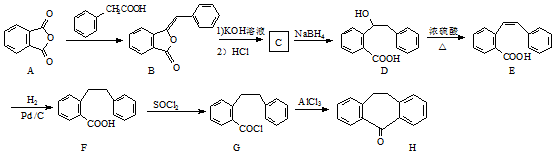
 .
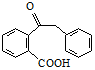
.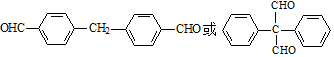 .
.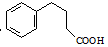 为原料制备
为原料制备 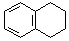 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干). 分析 (1)根据D的结构简式可以判断其中含氧官能团名称;
(2)根据D→E即在浓硫酸加热条件下脱去一份子水生成双键判断;
(3)根据C还原可得到D结合C的分子式为C15H12O3,和D的结构简式判断;
(4)①含有两个苯环且能发生银镜反应,说明含有醛基;
②分子中只有4种不同化学环境的氢,说明分子结构对称性比较好;据此分析判断;
(5)根据流程中的信息F→G→H分析书写.
解答 解:(1)由D的结构简式可以判断其中含氧官能团的名称为羟基和羧基,故答案为:羟基;羧基;
(2)由流程可知D→E即在浓硫酸加热条件下脱去一份子水生成双键,所以D→E的反应类型为消去反应,故答案为:消去反应;
(3)C还原可得到D,由D的结构式推出D的分子式为C15H14O3,又C的分子式为C15H12O3,所以C→D即增加2个H,则C的结构简式 ,故答案为:
,故答案为: ;
;
(4)①含有两个苯环且能发生银镜反应,说明含有醛基;②分子中只有4种不同化学环境的氢,说明分子结构对称性比较好,又除了2个苯环外,有2个O,2个不饱和度,所以应该为对称的2个醛基,则符合条件的同分异构体为 ;故答案为:
;故答案为:
(5)由流程中的信息F→G→H,则可以将羧基变成羰基,再根据C→D将羰基还原成羟基,后根据D→E→F经过消去加成去掉羟基即可,则流程图为: ,故答案为:
,故答案为: .
.
点评 本题考查有机物的推断与合成、官能团结构与性质、性质条件同分异构体书写等,注意掌握有机物官能团的性质和转化,结合反应条件与有机物结构进行分析,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 当混合气体的质量不变,说明反应已达平衡状态 | |
| B. | 缩小容器体积,重新达到平衡时,气体混合物中C%可能增大 | |
| C. | 在恒压容器中升高温度,气体混合物中C%可能先增大后减小 | |
| D. | 在恒容容器中升高温度,达到新平衡时,气体的密度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 氨碱法 | 联合制碱法 | ||
| A. | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
| B. | 副产物 | 氯化钙 | 氯化铵 |
| C. | 循环物质 | 氨气、二氧化碳 | 氯化钠 |
| D. | 评价 | 原料易得;设备复杂;能耗高 | 原料利用率高;废弃物少 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙中的热化学方程式为2C(g)?A(g)+3B(g);△H=+4Q2/3kJ/mol | |
| B. | 反应达到平衡前,甲中始终有v正大于v逆,乙中始终有v正大于v逆 | |
| C. | 在该条件下,反应2C(g)?A(g)+3B(g)的平衡常数为9×1.52(mol/L)2 | |
| D. | 乙中C的转化率为25% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-=BaSO4↓ | |
| D. | 将氢氧化铁放入盐酸中:Fe(OH)3+3H+=Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
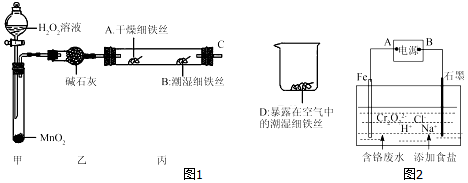
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com