
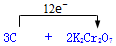 .
.分析 (1)该反应中C元素化合价由0价变为+4价、Cr元素化合价由+6价变为+3价,转移电子数为12,根据转移电子相等及原子守恒配平方程式;
(2)得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物;
(3)该反应中C失去电子转移给Cr元素;
(4)生成的气体是二氧化碳,二氧化碳的物质的量=$\frac{11g}{44g/mol}$=0.25mol,根据二氧化碳和转移电子之间的关系式计算.
解答 解:(1)该反应中C元素化合价由0价变为+4价、Cr元素化合价由+6价变为+3价,转移电子数为12,根据转移电子相等及原子守恒配平方程式为3C+2K2Cr2O7+8H2SO4(稀)=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O
,故答案为:3;2;8;3;2;2;8;
(2)得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物,该反应中氧化剂是K2Cr2O7,还原剂是C,氧化产物是CO2,
故答案为:K2Cr2O7;CO2;
(3)该反应中C失去电子转移给Cr元素,转移电子数为12,所以电子转移的方向和数目为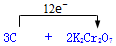 ,故答案为:
,故答案为: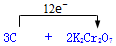 ;
;
(4)生成的气体是二氧化碳,二氧化碳的物质的量=$\frac{11g}{44g/mol}$=0.25mol,1molC反应转移4mol电子,则0.25mol反应转移1mol电子,转移电子数为NA,故答案为:NA.
点评 本题考查氧化还原反应计算、氧化还原反应配平、基本概念等知识点,为高频考点,明确元素化合价变化与基本概念关系、氧化还原反应中转移电子守恒等知识点是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A气体是NH3 | |
| B. | 悬浊液的离子主要有Na+、NH4+、Cl-、HCO3- | |
| C. | 第Ⅲ步操为过滤 | |
| D. | 第Ⅳ步操作所使用的仪器主要有铁架台、酒精灯、蒸发皿、玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
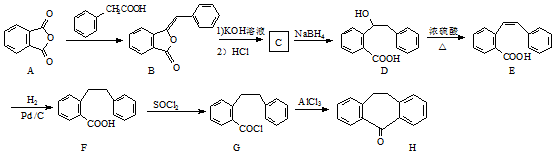
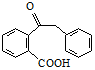 .
.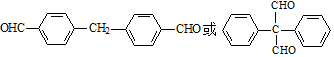 .
.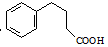 为原料制备
为原料制备 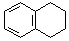 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
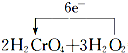 =2Cr(OH)3↓+3O2↑+2H2O.
=2Cr(OH)3↓+3O2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀 | |
| B. | 钢管与电源正极连接,钢管可被保护 | |
| C. | 钢管与铜管露天堆放在一起时,钢管不易被腐蚀 | |
| D. | 钢铁发生析氢腐蚀时,负极反应式:2H+-2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com