
分析 KMnO4酸性溶液与H2C2O4(草酸)溶液在酸性环境下会发生氧化还原反应,反应过程中高锰酸钾被还原,会褪色,根据溶液褪色所需的时间可以判断反应速率的大小.
解答 解:KMnO4酸性溶液与H2C2O4(草酸)溶液在酸性环境下会发生氧化还原反应:KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,反应过程中高锰酸钾被还原,会褪色根据溶液褪色所需的时间可以判断反应速率的大小,
故答案为:KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O;溶液褪色所需的时间.
点评 本题考查了探究浓度对反应速率的影响,题目难度中等,注意掌握温度、浓度、压强等对反应速率的影响,试题侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:解答题
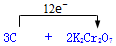 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
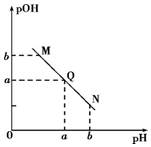
| A. | N点处pH>pOH,则N点处所示溶液呈酸性 | |
| B. | 该温度下水的离子积Kw=1×10-2a | |
| C. | Q点所示溶液呈中性,则M、N、Q三点中只有Q点溶液中水的电离出的c(H+)与水的电离c(OH-)相等 | |
| D. | M点所示溶液的导电能力强于Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ③⑤⑥ | C. | ①②④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
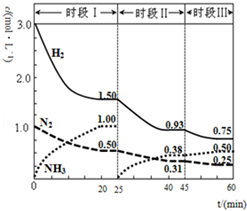 N2(g)+3H2(g)?2NH3(g);△H=-94.4kJ•mol-1.恒容时,体系中各物质浓度随时间变化的曲线如图.
N2(g)+3H2(g)?2NH3(g);△H=-94.4kJ•mol-1.恒容时,体系中各物质浓度随时间变化的曲线如图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
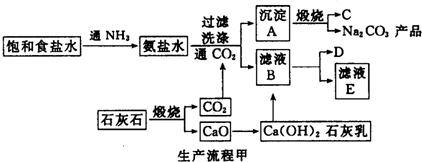

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作和现象 | 结论 |
| A | 室温下,向苯酚钠溶液中滴入NaHSO3溶液,出现白色浑浊 | C6H5O-结合质子的能力比SO32-强 |
| B | 向待测液X中依次滴入氯水、KSCN溶液,溶液变红 | 待测液X中一定含有Fe2+ |
| C | 向(NH4)2S2O8溶液中加入硝酸酸化的Mn(NO3)2溶液和1滴AgNO3溶液(作催化剂),微热,溶液变紫色 | S2O82-氧化性比MnO4-强 |
| D | 浓硫酸与乙醇共热产生的气体Y,通入酸性KMnO4溶液,溶液紫色褪去 | 气体Y为纯净的乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com