
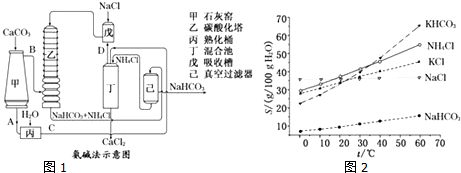
分析 (1)①98%浓硫酸为高沸点酸,能制取低沸点的酸氯化氢,食盐和浓硫酸反应生成氯化氢和硫酸钠;
②由题目信息可知,硫酸钠与石灰石、焦炭反应生成CaS、Na2CO3,根据元素守恒可知,还原C的氧化物CO或CO2生成;
(2)①碳酸钙加热分解生成CaO与CO2,故A为CaO,B为CO2,CaO在熟化桶内与水反应生成氢氧化钙;氢氧化钙与氯化铵在混合池内反应生成氨气与氯化钙;
②氨气与氯化钠溶液混合后,在乙中与二氧化碳发生反应,生成NaHCO3、NH4Cl;
(3)能提高原料的利用率,减少废渣的排放,保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高; NH4Cl 可做氮肥;可与合成氨厂联合,可利用合成氨的产物CO2;
(4)不可行.因为KHCO3和NH4Cl的溶解度相差不大,当温度高于40℃时,KHCO3的溶解度大于NH4Cl,降温结晶时会析出较多的KCl.
解答 解:(1)①利用高沸点酸制备挥发性酸,且HCl极易溶于水,故利用直接使用98%浓硫酸和氯化钠制取氯化氢,反应为:NaCl+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HCl↑或2NaCl+H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑,
故答案为:NaCl+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HCl↑或2NaCl+H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑;
②由题目信息可知,硫酸钠与石灰石、焦炭反应生成CaS、Na2CO3,根据元素守恒可知,还原C的氧化物CO或CO2生成,故反应方程式为:Na2SO4+4C+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaS+Na2CO3+2CO2,
故答案为:Na2SO4+4C+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaS+Na2CO3+2CO2;
(2)①碳酸钙加热分解生成CaO与CO2,故A为CaO,B为CO2,CaO在熟化桶内与水反应生成氢氧化钙,故C为Ca(OH)2;氢氧化钙与氯化铵在混合池内反应生成氨气与氯化钙,故D为NH3,
故答案为:Ca(OH)2;NH3;
②氨气与氯化钠溶液混合后,在乙中与二氧化碳发生反应,生成NaHCO3、NH4Cl,反应方程式为NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl,
故答案为:NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl;
(3)该方法能提高原料的利用率,减少废渣的排放,保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高;NH4Cl 可做氮肥;可与合成氨厂联合,可利用合成氨的产物CO2,
故答案为:提高食盐利用率、副产物氯化铵可用作化肥、可利用合成氨的产物CO2;
(4)由溶解曲线图可知KHCO3和NH4Cl的溶解度相差不大,当温度高于40℃时,由图象可知,降温结晶时会析出较多的KCl,无法大量析出碳酸氢钾;
故答案为:不可行; 因为KHCO3的溶解度较大,且在常温下与KCl溶解度相差小,当温度高于40℃时,由图象可知,降温结晶时会析出较多的KCl,无法大量析出碳酸氢钾.
点评 本题考查制碱法的工艺的流程,需要学生细读生产工艺图中各物质的变化进行解答,注意根据物质的主要性质分析工业装置和反应原理,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3•H2O | |
| B. | 2NO2+2OH-=NO3-+NO2-+H2O | |
| C. | SnCl4+2H2O=SnO2+4HCl | |
| D. | CO32-+CO2+H2O=2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
温度 盐 溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在t℃时,AgBr的Ksp为4.9×10-13 | |
| B. | 在t℃时,AgCl(s)+Br-(aq)═AgBr(s)+Cl-(aq)的平衡常数 K≈816 | |
| C. | 图中a点对应的是AgBr的不饱和溶液 | |
| D. | 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当混合气体的质量不变,说明反应已达平衡状态 | |
| B. | 缩小容器体积,重新达到平衡时,气体混合物中C%可能增大 | |
| C. | 在恒压容器中升高温度,气体混合物中C%可能先增大后减小 | |
| D. | 在恒容容器中升高温度,达到新平衡时,气体的密度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/oC | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.
氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-=BaSO4↓ | |
| D. | 将氢氧化铁放入盐酸中:Fe(OH)3+3H+=Fe3++3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com