
����Ŀ��POCl3�������뵼����Ӽ������άԭ�ϣ�ʵ�����Ʊ�POCl3���ⶨ��Ʒ������ʵ��������£�
I���Ʊ�PCl3
��1��ʵ�����ø�����غ�Ũ���ᷴӦ������������װ�ÿ�����ͼ�е�____������ĸ���ţ���
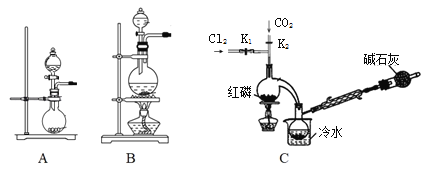
��2�����װ��C�����Բ�װ��ҩƷ���ȹر�K1����K2ͨ������CO2��һ��ʱ��ر�K2����������ƿͬʱ��K1ͨ�������������Ӧ�������С�ͼ�м�ʯ�ҵ�������______________��
II��ʵ�����Ʊ�POCl3��
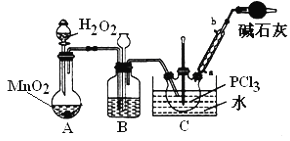
������������Һ̬PCl3����ȡPOCl3��ʵ��װ�ã����ȼ��г������ԣ���ͼ��
���ϣ���Ag++SCN����AgSCN����Ksp��AgCl����Ksp��AgSCN����
��PCl3��POCl3�������Ϣ���±���
���� | �۵�/�� | �е�/�� | ��Է������� | ���� |
PCl3 | ��112.0 | 76.0 | 137.5 | �����ܣ���Ϊ��ɫҺ�壬��ˮ�����ҷ�Ӧ���ɺ�������Ȼ��� |
POCl3 | 2.0 | 106.0 | 153.5 |
��3��POCl3�ڳ�ʪ�����л���ҡ����̡�����Ӧ�Ļ�ѧ����ʽΪ___________________________________��
��4����Ӧ�¶�Ҫ������60��65�棬ԭ���ǣ�_________________________________��
��5��ͨ��������·����Բⶨ��Ʒ��ClԪ�غ�����ʵ�鲽�����£�
a��ȷ��ȡ15.0 g POCl3��Ʒ������ʢ��60.00 mL����ˮ��ˮ��ƿ��ҡ������ȫˮ�⣬��ˮ��Һ���100.00 mL��Һ��
b��ȡ10.00 mL��Һ����ƿ�У�����10.00 mL 3.2 molL��1 AgNO3����Һ��
c��������������������ҡ����ʹ�������汻�л��︲�ǡ�
d����NH4Fe (SO4) 2Ϊָʾ������0.2 molL��1 NH4SCN��Һ�ζ�������AgNO3��Һ���ﵽ�ζ��յ�ʱ����ȥl0.00 mL NH4SCN��Һ��
�ٲ���d�дﵽ�ζ��յ��������__________________________________________��
�ڲ�Ʒ��ClԪ�ص���������Ϊ______________������3λ��Ч���֣���
���𰸡�A ����β��������ֹ�����е�ˮ��������������ƿ POCl3+3H2O��H3PO4+3HCl �¶ȹ��ͣ���Ӧ�ٶ�̫�����¶ȹ��ߣ�PCl3�ӷ��������ʵ� ��Һ����ɫ��Ϊ��ɫ��30 s�ڲ��ٱ�ɫ 71.0%
��������
I����1��������غ�Ũ���ᷴӦ�����������ڹ����Һ�巴Ӧ����Ӧ����Ҫ���ȣ��ݴ�ѡ��װ�ã�
��2�����������ж�����ƷPCl3��ˮ�����ҷ�Ӧ���ɺ�������Ȼ�����з�����
II��ʵ�����Ʊ�POCl3��Aװ������˫��ˮ��������̷�Ӧ����������ͨ������˫��ˮ���������Կ��Ʋ������������ʣ������к���ˮ������Ũ�����ȥ������Bװ����װŨ���ᣬװ��B���г���©��������ƽ��װ�������ѹǿ����ȫƿ�����ã����������������Ȼ���Ӧ����POCl3��Ϊ�˿��Ʒ�Ӧ������Ҫ��ֹ���Ȼ��ӷ�����Ӧ���¶ȿ�����60��65��������װ��C����ˮԡ��Ϊ��ֹPOCl3�ӷ����������ܽ�������������POCl3��ˮ������ˮ��Ϊ��������Ȼ��⣬����Ϊ��ֹ������ˮ��������װ�ã�ͬʱ����β����������װ�õ�������м�ʯ�ҵĸ���ܣ��ݴ˷����ش����⡣
I����1�������Һ�巴Ӧ����Ӧ����Ҫ���ȣ��ݴ�ѡ��װ��A��
�𰸣�A��
��2�����������ж������β�������ŷŵ������У���ƷPCl3��ˮ���ҷ�Ӧ��Ҫ��ֹ�����е�ˮ��������������ƿ��
�𰸣�����β��������ֹ�����е�ˮ��������������ƿ��
II����3��POCl3�ڳ�ʪ�����л��������������ȷ����HCl���ɣ�������Ԫ�صĻ��ϼۻ�����ȷ�����������ɣ�����ʽΪPOCl3+3H2O��H3PO4+3HCl��
�𰸣�POCl3+3H2O��H3PO4+3HCl ��
��4����������ķ�����֪����Ӧ�¶�Ӧ������60��65����ԭ�����¶ȹ��ͣ���Ӧ����С���¶ȹ��ߣ����Ȼ���ӷ��������ʵͣ�
�𰸣��¶ȹ��ͣ���Ӧ�ٶ�̫�����¶ȹ��ߣ�PCl3�ӷ��������ʵ� ��
��5����ΪFe3+��SCN-��ϣ���Һ���죬�����NH4Fe (SO4) 2Ϊָʾ������0.2 molL��1 NH4SCN��Һ�ζ�������AgNO3��Һ���ﵽ�ζ��յ����������Һ����ɫ��Ϊ��ɫ��30 s�ڲ��ٱ�ɫ��
�𰸣���Һ����ɫ��Ϊ��ɫ��30 s�ڲ��ٱ�ɫ��
��6���ⶨPOCl3��Ʒ��������POCl3��ˮ��Ӧ�����Ȼ��⣬Ȼ��������������Һ������Һ�е������ӣ�NH4SCN��Һ�ζ�������AgNO3��Һ������NH4SCN�����ʵ����ɼ������Һ��ʣ���AgNO3�����AgNO3�������ʵ�����֪�������ӷ�Ӧ���������������������Һ�������ӵ����ʵ���������ȷ����Ԫ�ص�����������NH4SCN�����ʵ���Ϊ0.2mol/L��0.01L=0.002mol�����ݷ�ӦAg++SCN-=AgSCN������֪��Һ��ʣ��������ӵ����ʵ���Ϊ0.002mol��POCl3��ˮ��Ӧ�����Ȼ�������ʵ���Ϊ��3.2��0.01mol-0.002mol����10=0.3mol����Ԫ�ص���������Ϊ![]() ��100%=71.0%��
��100%=71.0%��
�𰸣�71.0%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������о���Ա������ú��������Ȼ�ѧѭ��ʵ��̫���ܵ�ת����洢���������£�
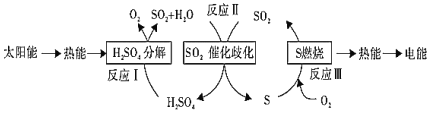
(1)��Ӧ��2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ��H1=+551 kJ��mol��1
��Ӧ��S(s)+O2(g)![]() SO2(g) ��H3=-297 kJ��mol��1
SO2(g) ��H3=-297 kJ��mol��1
д����Ӧ����Ȼ�ѧ����ʽ��_____________________��
(2)�绯��Ӧ�ɼ�����Ϊ��ѧ��Ӧ��ͬһ��Ӧ����ijԪ�ػ��ϼ�ͬʱ������������֪I-���ӿ�����Ϊˮ��Һ��SO2�绯��Ӧ�Ĵ������й����ӷ���ʽ���£�δ��ƽ����
a.SO2+I-+H+��S��+I2+H2O
b.I2+H2O+SO2��SO42-+H++I-
i.����ͼʾ���������ӷ���ʽa��b��д��SO2�绯��Ӧ����ʽ��______________��
ii.̽��a��b��Ӧ������SO2�绯��Ӧ���ʵĹ�ϵ��ʵ�����£��ֱ�18 mL SO2������Һ���뵽2 mL�����Լ��У��ܱշ��ù۲�������֪��I2���ܽ���KI��Һ�У�
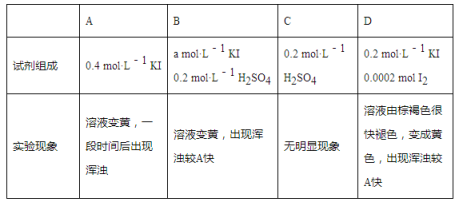
��B��A�ĶԱ�ʵ�飬��a=__________��
�ڱȽ�A��B��C���ɵó��Ľ�����______________________��
��ʵ�������SO2���绯��Ӧ����D>A����Ϣ١��ڷ�Ӧ���ʽ���ԭ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Bilirubin��һ�������Ĺ������·����ֽⷴӦ����Ӧ��Ũ���淴Ӧʱ��仯����ͼ��ʾ�����㷴Ӧ4��8 min���ƽ����Ӧ���ʺ��ƲⷴӦ16 minʱ��Ӧ���Ũ�ȣ����Ӧ��( ����)
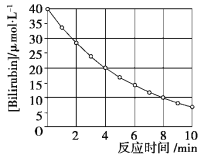
A.2.5 ��mol��L��1��min��1��2.0 ��mol��L��1
B.2.5 ��mol��L��1��min��1��2.5 ��mol��L��1
C.3.0 ��mol��L��1��min��1��3.0 ��mol��L��1
D.5.0 ��mol��L��1��min��1��3.0 ��mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪:��Cl2ͨ������KOH��Һ��,�����п��ܺ���KCl��KClO��KClO3,��![]() ��ֵ���¶ȸߵ��йء���n(KOH)=a molʱ,����˵������ȷ����
��ֵ���¶ȸߵ��йء���n(KOH)=a molʱ,����˵������ȷ����
A.�μӷ�Ӧ�����������ʵ�������![]() a mol
a mol
B.�ı��¶�,������KClO3��������۲���Ϊ![]() a mol
a mol
C.�ı��¶�,��Ӧ��ת�Ƶ��ӵ����ʵ���n(e-)�ķ�ΧΪ![]() a mol��n(e-)��
a mol��n(e-)��![]() a mol
a mol
D.��ij�¶���,��Ӧ��![]() =11,����Һ��
=11,����Һ��![]() =
=![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ߵ���H5IO6����MnSO4��Һ�п�ʹ��Һ���Ϻ�ɫ����֪H5IO6�ڷ�Ӧ�з������¹��̣�H5IO6��HIO3�����������գ�
��1�����÷�Ӧ������������ԭ������ƽ���ϵ��������ȷλ�ã����õ����ŷ���������ת�Ƶķ������Ŀ��________________
��2������2 mol��HIO3ת�Ƶĵ�����Ϊ___________
��3������H5IO6��Һ�м����������������ʣ��ܽ���Ԫ�ػ�ԭ��I����_____��ѡ����ţ�
a.���� b.���� c.�廯�� d.��������
��4������H5IO6����Һ�м�������Ĺ���������Һ���ټ��������Һ����Һ������ͬʱ�д��������������д���˷�Ӧ�Ļ�ѧ����ʽ��___________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽��������̬����������ʣ�ijͬѧ���������ʵ�飺����ֻ����ƿ�ռ������������������壬������ˮ���С�Ȼ�ֱ���ͨ��������������������ͼ��ʾ��һ��ʱ���A��Bװ���м���ƿ������Һ��Cװ���м���ƿ�ﻹ�����塣

(1)���װ��A��ͨ�������ǡ��ʹҺ���������ƿ������ƿ��Һ�岻��ɢ��
��д��A���ܷ�Ӧ�Ļ�ѧ����ʽ��________����ʵ��Թ�ҵ�������������ʾ��________��
�ڼ����ʵ�������£�����Ħ�����ΪaL��mol��1������ƿ����Һ�����ʵ���Ũ��Ϊ________��
(2)ʵ��ǰ��Cˮ����μӼ�����ɫʯ����Һ��ͨ������ǰ��ʵ������仯����Ϊ___________��д����ѧ����ʽ��________����Һ��������ƿ����Bˮ����μ����ᱵ��Һ�����ܹ۲쵽������Ϊ___________��д�����з�Ӧ�����ӷ���ʽ��_________��֤��Bˮ�۷�Ӧ����Һ���������ӵIJ���������______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ�������������Ϣ���ɡ��������漰��Ԫ�ؾ�Ϊ��ѧ��ѧ�г����Ķ�����Ԫ�أ���ԭ�Ӱ뾶����Ҫ���ϼ��б����£�����R2Q2���ں������DZˮͧ����Ϊ������Դ��

����˵����ȷ����
A. T��Z������������Ӧˮ���������T<Z
B. R��X��Y�ĵ���ʧȥ����������ǿ����X
C. M��Q�γɵ������ӻ�����
D. M��Q��Z���ڵ�2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1mol��KCl��0.1mol��AlCl3����ˮ���100mL�����Һ��������Һ��Cl-Ũ����û����Һ��Cl-Ũ����ȵ���
A. 3mol/L��NaCl��Һ B. 2mol/L��FeCl3��Һ
C. 2mol/L��MgCl2��Һ D. 2mol/L��NaCl��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ�������������ѧ����Ҫ�Ļ���������Ӧ��
��1�����Ṥҵ�����нӴ����ڷ����ķ�Ӧ����ʽΪ___����ʵ�����������У������¶�ѡ��400-500���϶ȣ�ѹǿ���ó�ѹ��ԭ��ֱ���___��
��2���ϳɰ���Ӧ���ɵİ��������ڹ�ҵ�ƴ��д���������Ȼ��ơ�������̼��ˮΪԭ���Ʊ�����Ļ�ѧ����ʽ___��___��
��3���ϳɰ�ÿ����1gҺ�����ų�QkJ��������д���Ȼ�ѧ��Ӧ����ʽ___��
��4������Ũ��ˮ��������ȹܵ��Ƿ�й©��й©����۲쵽�����İ��̣�NH4Cl����������һ����ɫ��ζ�ĵ������壬д���˷�Ӧ�Ļ�ѧ����ʽ���������ת�Ƶķ������Ŀ____���÷�Ӧ�б���ԭ����___����ԭ������___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com