
| A. | 在化学反应过程中,发生物质变化的同时一定发生能量变化 | |
| B. | 破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,反应为吸热反应 | |
| C. | 反应产物的总焓大于反应物的总焓时,反应吸热,△H>0 | |
| D. | 热化学方程式中反应热数值的大小与化学方程式的计量数成比例 |
分析 A.化学反应中反应物化学键断裂化学键吸收能量,生成物形成化学键放出热量;
B.△H=断裂化学键的能量和-成键的能量和;
C.△H=反应物的总焓-生成物的总焓;
D.热化学反应方程式中,热效应数值与反应物的物质的量的多少有关.
解答 解:A.化学反应中反应物化学键断裂化学键吸收能量,生成物形成化学键放出热量,所以在化学反应过程中,发生物质变化的同时一定发生能量变化,故A正确;
B.△H=断裂化学键的能量和-成键的能量和,破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,△H<0,反应为放热反应,故B错误;
C.△H=反应物的总焓-生成物的总焓,反应产物的总焓大于反应物的总焓时,则△H>0,反应吸热,故C正确;
D.热化学反应方程式中,热效应数值与反应物的物质的量的多少有关,热化学方程式中反应热数值的大小与化学方程式的计量数成比,故D正确.
故选B.
点评 本题考查化学反应与能量变化、反应热、焓变,把握常见反应中的能量变化为解答的关键,注意焓变的计算及常见的吸热反应、放热反应,题目难度不大.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若单位时间生成xmolNO的同时,消耗1.5xmolH2O,则反应达到平衡状态 | |
| B. | 达到平衡状态后,NH3、O2、NO、H2O(g)的物质的量之比为4:5:4:6 | |
| C. | 达到平衡状态时,若增加容器体积,则反应速率增大 | |
| D. | 达到平衡时,5v正(O2)=4v逆(NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③ | C. | ②③④ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验I | 实验II | 实验III | |
| 反应温度/℃ | 800 | 800 | 850 |
| c( A)起始/mol•L-1 | 1 | 2 | 1 |
| c( A)平衡/mol•L-1 | 0.5 | 1 | 0.85 |
| 放出的热量/kJ | a | b | c |
| A. | 化学平衡常数实验III的小于实验I的 | |
| B. | 实验放出的热量关系为b>2a | |
| C. | 实验III 在30min达到平衡,用A表示此段时间的平均反应速率v (A)为0.005mol•L-1•min-1 | |
| D. | 当容器内气体密度不随时间而变化时上述反应已达平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
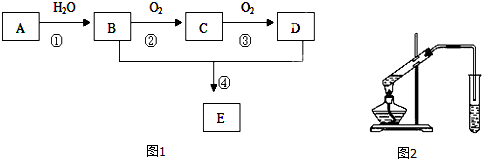
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 操作步骤 | 现象 |
| 实验1 | 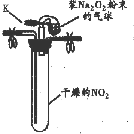 ①按如图组装仪器,打开K,将气球中的Na2O2粉末导入试管中,振荡,充分反应 | 试管内红棕色消失,气球变瘪 |
| ②试管冷却后,打开胶塞,加入5mL蒸馏水 | 未见红棕色气体,试管底部固体全部溶解得澄清溶液 |
| 序号 | 操作步骤 | 现象 |
| 实验2 | 取实验1所得清液, 向其中加入少量MnO2粉末,待不再产生气泡后,静置后取上层清液,再调节此溶液pH至7左右 | / |
| 实验3 | 取实验2后的清液2mL,加入2滴0.1%的酸性KMnO4溶液 |
| 序号 | 操作步骤 | 现象 |
| 实验4 | ①向试管中加入2mL新制FeSO4溶液,再加入10滴0.1mol•L-1NaNO3溶液,振荡,再向试管中加入0.5mL98%的浓硫酸 | 滴入NaNO3溶液,无明显变化,加入浓硫酸后,溶液变棕色 |
| ②向试管中加入2mL新制FeSO4溶液,再加入10滴0.1mol•L-1NaNO2溶液,振荡,再向试管中加入0.5mL98%的浓硫酸 | 加入NaNO2溶液,立即变棕色,加入浓硫酸后,溶液无明显变化 | |
| ③向试管中加入2mL新制FeSO4溶液,再加入10滴实验2后的清液,振荡,再加0.5mL98%的浓硫酸 | 滴加实验2得到的清液后,溶液立即变浅棕色,加入浓硫酸后,溶液变深棕色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
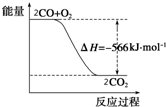 已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1| A. | CO的燃烧热为566 kJ•mol-1 | |
| B. | 如图可表示由CO生成CO2的反应过程中能量变化的过程 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H=-452 kJ/mol | |
| D. | CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com