
����Ŀ����1������ȼ�ϵ����һ�ָ�Ч����Ⱦ����������ּ��ԣ���KOH������ʣ������ԣ�������������ʣ�ȼ�ϵ�ء����������ȼ�ϵ�أ���������Ӧ����ʽ��___��
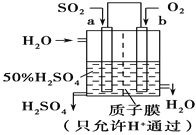
��2��������Ա��������ͼԭ���װ���������ᣬ���ĵ缫��ӦʽΪ___��
��3�����Ȼ�����(S2Cl2)��һ������ɫҺ�壬�Ǻϳ���Ⱦ�ϵ���Ҫԭ�ϡ�
a.S2Cl2����������ԭ�Ӷ�����8�����ȶ��ṹ��д�����ĵ���ʽ__��
b.ָ���������ڵļ���__��
��4������ʽΪC5H12O���л����������Ʒ�Ӧ������������__�֣������ܹ���������������ȩ����___�֡�
��5�������л��б�ϩ���ʣ�д�����ӵĻ�ѧ��Ӧ����ʽ__��
���𰸡�O2+4e-+4H+=2H2O SO2-2e-+2H2O=SO![]() +4H+
+4H+ ![]() ���Լ��ͷǼ��Լ� 8 4 CH3��CH=CH2+Br2��CH3��CHBr��CH2Br
���Լ��ͷǼ��Լ� 8 4 CH3��CH=CH2+Br2��CH3��CHBr��CH2Br
��������
����ԭ���ԭ����������ԭ��Ӧԭ����д�缫��Ӧʽ�����ݼۼ�������д����ʽ�����ݹ���������ȷ���л������࣬ͨ��̼���칹��λ���칹ȷ��ͬ���칹��������
��1����������ȼ�ϵ�أ���������������ԭ��Ӧ����������Ӧ����ʽ��O2+4e-+4H+=2H2O��
��2������ͼ����������������Ӧ�������ᣬa��Ϊ����������������ԭ��Ӧ����ˮ��b��Ϊ���������ĵ缫��ӦʽΪSO2-2e-+2H2O=SO![]() +4H+��
+4H+��
��3��a.Sԭ���������6�����ӣ��õ�2�����ӻ��γ����Թ��õ��ӶԴﵽ8���ӽṹ��Clԭ���������7�����ӣ��õ�1�����ӻ��γ�1�Թ��õ��ӶԴﵽ8���ӽṹ��S2Cl2����������ԭ�Ӷ�����8�����ȶ��ṹ�����ĵ���ʽ![]() ��
��
b.���ݵ���ʽ��֪���������ڵļ���Ϊ���Լ���S��Cl�����ͷǼ��Լ���S��S������
��4������ʽΪC5H12O���л����������Ʒ�Ӧ��������������Ϊ��������̼���칹��λ���칹��ͬ���칹����8�֣������ܹ���������������ȩ��˵���ṹ�к��С�CH2OH������д��C4H9CH2OH��C4H9����4�֣����ܹ���������������ȩ��ͬ���칹����4�֡�
��5�������л��б�ϩ���ʣ������ṹ �Ƚ��ȶ���ϩ�������ӳɷ�Ӧ���ʳ��ӱ�ϩ��������ˮ����ѧ��Ӧ����ʽCH3��CH=CH2+Br2��CH3��CHBr��CH2Br��


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д� �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1mol��L��1MgSO4��0.05mol��L��1Al2(SO4)3��Һ����ʵ�飺����ȡ25mL���ֱ�μ�0.5mol��L��1NaOH��Һ�������ҺpH��V(NaOH)�Ĺ�ϵ��ͼ1������������Һ�������Ϻ�ȡ��25mL����μ�������NaOH��Һ���۲�����������ȷ���� (����)
ͼ1 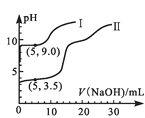 ͼ2
ͼ2
A.ͼ1�е�����II��ʾMgSO4��NaOH��Ӧ�Ĺ�ϵ
B.����ͼ1�ɵ�Ksp[Al(OH)3]��ֵ����1.0��10��32
C.ʵ������Al(OH)3��ȫ�ܽ�ǰ����Һ��c(Mg2+)/c(Al3+)���
D.ͼ2���Ա�ʾʵ������n(����)��V(NaOH)�Ĺ�ϵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�л���A�ĺ�����ͺ˴Ź���������ͼ��ʾ������˵���д�����ǣ� ��
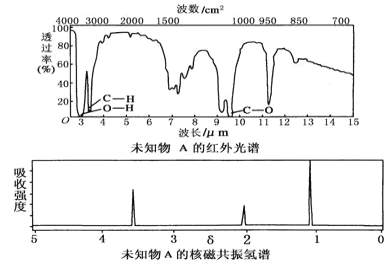
A.�ɺ������֪�����л��������������ֲ�ͬ�Ļ�ѧ��
B.�ɺ˴Ź�������֪�����л�������������ֲ�ͬ��ѧ��������ԭ��
C.������˴Ź�����������֪������е���ԭ������
D.��A�Ļ�ѧʽΪC2H6O������ṹ��ʽΪCH3��O��CH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����֪�л���A����Է���������28�����IJ����Ǻ���һ������ʯ�ͻ���ˮƽ�ı�־��B��D�����ճ�����ʳƷ�г������л��E�Ǿ���Ũ����ζ����������ˮ����״Һ�壬F��һ�ָ߾����������������ʳ�ﱣ��Ĥ��
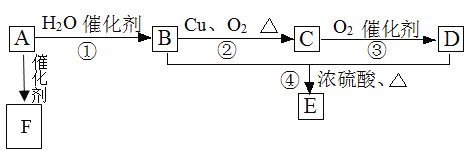
��1����д��A�Ľṹ��ʽ___��C�Ľṹʽ___��
��2����д����B�й����ŵĵ���ʽ___��D�й����ŵ�����___��
��3����д�����з�Ӧ�����ͣ���___����___����___��
��4����д����������ת���Ļ�ѧ����ʽ��
A��F��___��
B��C��___��
B+D��E��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�����ר�Һ�°���������Ƽ����Ϊ�����Ƽҵ������ͻ�����ס�����NaCl��NH3��CO2��Ϊԭ�����Ƶ�NaHCO3����������������йط�Ӧ�Ļ�ѧ����ʽΪ��NH3��CO2��H2O=NH4HCO3��NH4HCO3��NaCl=NaHCO3����NH4Cl��2NaHCO3![]() Na2CO3��CO2����H2O��
Na2CO3��CO2����H2O��
�ش��������⣺
��1��̼������뱥��ʳ��ˮ��Ӧ��������̼�����ƾ����ԭ����___������ĸ��ţ���
a��̼������������ˮ
b��̼�����������ֽ�
c��̼�����Ƶ��ܽ����Խ�С����������Һ�����Ƚᾧ����
��2��ij̽���С����������Ƽ�ԭ��������̼�����Ƶ��Ʊ�ʵ�飬ͬѧ�ǰ�������Ƶķ���ʵ�顣
��һλͬѧ��������̼����ͨ�뺬���ı���ʳ��ˮ���Ʊ�̼�����ƣ�ʵ��װ����ͼ��ʾ��ͼ�мг֡��̶��õ�����δ��������
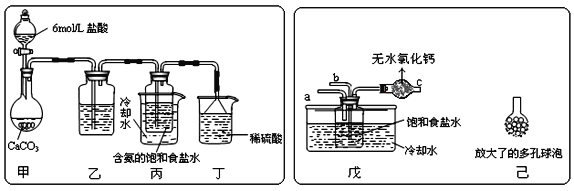
�Իش������й����⣺
������װ���е��Լ���___��
����װ����ϡ�����������___��
����ʵ����������NaHCO3����IJ�����___���������������ƣ���
����һλͬѧ��ͼ����װ�ã�����װ��δ����������ʵ�顣
����ʵ��ʱ�����ȴ�___��ͨ��___���壬�ٴ�___����ͨ��___���壻
������ͬѧ��������װ�õ�b���¶����Ӽ�װ�ã�������___��
��3��������д��һ��ʵ������ȡ����̼�����Ƶķ�����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС������NaI��Һ��ͨ������Cl2�õ������Һ�������ú����Һ��ȡNaI���壬ʵ���������£�

��֪��Ӧ����2I��+2Cu2++![]() +H2O
+H2O![]() 2CuI��+
2CuI��+![]() +2H+��
+2H+��
�ش��������⣺
��1������ʵ������Ҫ�IJ�����������ͨ©�����ձ���_____________��
��2����Ӧ����CuI����������ԭ����ֻ��NO2���÷�Ӧ�Ļ�ѧ����ʽΪ_________________������95.5 g CuI���뷴Ӧ������Ҫ�����______________L��O2���ܽ����ɵ�NO2��ˮ����ȫת��Ϊ���ᡣ
��3��������B�к�����Ԫ�أ���ԭ������һ��Ԫ��ԭ�ӵ����ʵ���֮��Ϊ3��8������B�Ļ�ѧʽΪ_____________��
��4����Ӧ�������ɺ�ɫ�������ɫ���壬��ɫ������׳�Ϊ��������������Ӧ���Ļ�ѧ����ʽΪ______��
��5����������Cl2ͨ�뺬12 g NaI����Һ�У�һ��ʱ������Һ���ɵõ����������Ϊ_________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������ܱ������У��������»�ѧ��Ӧ��CO2��g��+H2��g��![]() CO��g��+H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
CO��g��+H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�ӦΪ___��Ӧ��ѡ�����ȡ����ȣ���
��2��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c��CO2����c��H2��=c��CO����c��H2O�������жϴ�ʱ���¶�Ϊ___�档
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.�ⶨ��ѧ��Ӧ����
ijͬѧ������ͼװ�òⶨ��ѧ��Ӧ���ʡ�
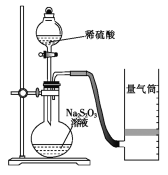
(��֪��S2O32-+2H+=H2O+S��+SO2��)
��1��Ϊ��֤ʵ��ȷ�ԡ��ɿ��ԣ����ø�װ�ý���ʵ��ǰӦ�Ƚ��еIJ�����__������ͼ��ʾ��ʵ����Ʒ�������⣬����Ҫ��һ��ʵ��������__��
��2������2minʱ�ռ���224mL(������ɱ�״��)���壬�ɼ������2min��H+�ķ�Ӧ���ʣ����òⶨֵ��ʵ��ֵƫС����ԭ����___��
��.Ϊ̽�ֻ�ѧ��Ӧ���ʵ�Ӱ������
ijС������H2C2O4��Һ������KMnO4��Һ��Ӧ��̽������������Ի�ѧ��Ӧ���ʵ�Ӱ�족����֪��5H2C2O4+2KMnO4+3H2SO4=K2SO4+2MnSO4+10CO2��+8H2O
ʵ��ʱ��ͨ���ⶨ��ɫ����ʱ�����жϷ�Ӧ�Ŀ�������ѡ�Լ���������0.20mol/LH2C2O4��Һ��0.010mol/L����KMnO4��Һ������ˮ����ƿ������ˮԡ�ۣ���Ͳ���������С����������µķ�����
������ | ˮ | H2C2O4��Һ | ����KMnO4��Һ | �¶�/�� | ||
���/mL | Ũ��/molL-1 | ���/mL | Ũ��/molL-1 | ���/mL | ||
�� | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
�� | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
�� | 1.0 | 0.010 | 4.0 | 25 | ||
��1����֪��Ӧ��H2C2O4ת��ΪCO2�ݳ���KMnO4ת��ΪMnSO4��Ϊ�˹۲쵽��ɫ��ȥ��H2C2O4��KMnO4��ʼ�����ʵ�����Ҫ����Ĺ�ϵΪ��n(H2C2O4)��n(KMnO4)��__��
��2��ʵ��۲��KMnO4��Һ����ɫʱ��Ϊ40s�����Ի��ǰ����Һ�����С�仯�����ʱ����ƽ����Ӧ����v��KMnO4��=__mol��L-1��min-1��
��3������ɱ����ڶ����հ�__��__��
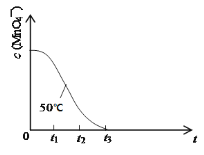
��4����֪50��ʱc(MnO4-)����Ӧʱ��t�ı仯������ͼ�����з�Ӧ�������Ľ���__��ԭ����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС���ͬѧ������ͼ��ʾʵ��װ�ý���ʵ��(ͼ��a��b��c��ʾֹˮ��) ��

(1)A��C��E�������װ�ÿ�������ȡCl2��������ص�����ʵ�顣�����ڱ��м�������ˮ�������Ƶ���ˮ����������ˮ����ʵ�飬ʵ����������������£�
ʵ����� | �� �� | �� �� |
��ˮ�м���̼�����Ʒ�ĩ | ����ɫ���ݲ��� | ������ˮ��Ӧ�IJ���������� |
ʵ��Ľ����Ƿ����__________����ѡ�������������˵������______________________������������װ�����һ����ʵ����֤Cl-��S2-�Ļ�ԭ��ǿ��,��ס��ҡ�����ʢ�ŵ��Լ��Ǽ�__________________ ��__________________ ��__________________
(2)B��D��Eװ����������B��ʢװŨ�����ͭƬ(�����п����ϰ���)�����Ƶò�����NO2�й�ʵ�顣����Dװ����֤NO2��ˮ�ķ�Ӧ�����������Ϊ���ȹر�ֹˮ��________���ٴ�ֹˮ��________��ʹ�ձ��е�ˮ�����Թܶ��IJ����ǣ�___________________________________ʹ�Թ��е������ݳ���NO2��ˮ�Ӵ��������ձ��е�ˮ�����Թܶ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com