
【题目】利用如图所示装置,以NH3作氢源,可实现电化学氢化反应。下列说法错误的是

A.a为阴极
B.b电极反应为:2NH3-6e-=N2+6H+
C.电解一段时间后,装置内H+数目增多
D.理论上每消耗1 mol NH3,可生成1.5mol![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在四个不同的容器中,在不同的条件下进行合成氨反应:N2(g)+3H2(g)![]() 2NH3(g),根据下列在相同时间内测定的结果判断,生成氨的速率最快的是
2NH3(g),根据下列在相同时间内测定的结果判断,生成氨的速率最快的是
A.v(H2)=0.2mol·L-1·min-1
B.v(N2)=0.2 mol·L-1·min-1
C.v(N2)=0.02 mol·L-1·s-1
D.v(H2)= 0.04 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟工业制硝酸原理的实验装置。先用酒精灯对硬质玻璃管里的三氧化二铬加热,然后把空气鼓入盛有浓氨水的锥形瓶,当三氧化二铬保持红热状态时,移去酒精灯。根据题意回答问题:

(1)硬质玻璃管里发生反应的化学方程式为______。当三氧化二铬红热时,要移去酒精灯,原因是:______。
(2)圆底烧瓶里的实验现象是______,鼓入空气的作用是______。
(3)实验过程中,如果慢慢地鼓入空气,石蕊溶液的颜色______。
(4)实验结束后,在圆底烧瓶内壁上有时会看到少量无色晶体,写出生成该晶体的化学方程式:______。
(5)工业上要获得浓度较大的硝酸,往往在稀硝酸中加入吸水剂硝酸镁或浓硫酸,然后______(填一种操作名称)。
(6)实验室里保存浓硝酸要用棕色瓶的原因是__________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有研究人员在体外实验中发现药物瑞德西韦对新冠病毒有明显抑制作用。![]() 是合成瑞德西韦的中间体,其合成路线如下:
是合成瑞德西韦的中间体,其合成路线如下:

回答下列问题:
(1)A的化学名称为________;反应④的反应类型为________。
(2)B中含氧官能团的名称为________;R的结构简式为________。
(3)写出反应②的化学方程式________。
(4)满足下列条件的B的同分异构体有________种(不包括立体异构)。
①苯的二取代物且苯环上含有硝基;②可以发生水解反应。
上述同分异构体中核磁共振氢谱为3:2:2的结构简式为________。
(5)结合题给信息和已学知识,设计由苯甲醛为原料制备 的合成路线(无机试剂任选)________。
的合成路线(无机试剂任选)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是
A.0.5 mol雄黄(As4S4)(结构如图:![]() )含有NA个S—S键
)含有NA个S—S键
B.1 mol CO和N2混合气体中含有的质子数为14NA
C.标准状况下,33.6L二氯甲烷中含有氯原子的数目为3NA
D.高温下,16.8 g Fe与足量水蒸气完全反应,转移的电子数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,100 mL 0.10 mol·L-1 H2A溶液用0.10 mol·L-1NaOH溶液滴定,滴定曲线如图所示。已知:p![]() = -lg
= -lg![]() 。下列说法不正确的是
。下列说法不正确的是

A.水的电离程度:Y>X>W
B.NaHA溶液呈酸性
C.反应H2A+A2- ![]() 2HA-的平衡常数K=105.6
2HA-的平衡常数K=105.6
D.Y点溶液中:c (Na+)=c (OH-)+3c (HA-)-c (H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯德榜制碱法可以做到连续循环生产,其工艺流程如下图所示。完成下列填空:

(1)写出流程中主反应的化学方程式:_________。
(2)流程通过同时利用合成氨厂产生的_______来降低原料成本。副产物b的化学式为______,简述降温条件下加入原料A的作用__________。侯氏制碱法的创新之处就是对母液的循环利用,这是由于母液中含有大量的![]() 、
、![]() 、_______离子。
、_______离子。
某兴趣小组同学制定如下两个方案对含有![]() 杂质的纯碱的含量进行测定:
杂质的纯碱的含量进行测定:
方案一:用如图装置测定样品与足量稀硫酸反应生成![]() 的体积。
的体积。
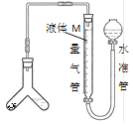
(3)为了减小实验误差,量气管中液体M的选择原则是______。若实验测得样品纯碱含量低于样品实际含量,可能的原因是_________
a ![]() 气体中含有水蒸气 b 测定气体体积时未冷却至室温
气体中含有水蒸气 b 测定气体体积时未冷却至室温
c Y型管中留有反应生成的气体 d 测定气体体积时水准管的液面高于量气管的液面
方案二:通过以下流程测定样品的含量。

(4)操作Ⅰ的名称为________,实验中,恒重的标准为________。根据以上实验过程,含有氯化钠的纯碱样品中碳酸钠的质量分数可表示为:_______。(注明你的表达式中所用的有关符号的含义)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用8.7g的MnO2与50mL足量的浓盐酸制取氯气,其反应方程式为:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)求生成氯气的体积(标准状况)______________
(2)若向反应后的剩余溶液中,加入足量AgNO3溶液,生成沉淀57.4g,求原浓盐酸的物质的量浓度______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,属于吸热反应的是( )
①液态水的汽化 ②将胆矾加热变为白色粉末
③浓硫酸稀释 ④KCl03分解制氧气
⑤生石灰跟水反应生成熟石灰
⑥CaCO3高温分解⑦CO2+C![]() 2CO
2CO
⑧Ba(OH)2·8H2O与固体NH4Cl混合
⑨C(s)+H2O(g)![]() CO(g)+H2(g)⑩Al与盐酸反应
CO(g)+H2(g)⑩Al与盐酸反应
A. ②③④⑤⑥⑦⑧⑨ B.②④⑥⑦⑧⑨ C.②④⑥⑧ D.②③④⑧⑨
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com