
 用纯净的碳酸钙跟稀盐酸反应制取二氧化碳气体.请回答问题:
用纯净的碳酸钙跟稀盐酸反应制取二氧化碳气体.请回答问题:分析 (1)根据曲线斜率判断反应速率;
(2)碳酸钙跟稀盐酸反应放热,溶液温度升高,反应速率加快,F→G,盐酸浓度降低,反应速率减慢;
(3)增大浓度、升高温度、增大接触面积等均可加快反应速率,反之,减小反应物的浓度,反应速率减慢.
解答 解:(1)曲线斜率大小决定反应速率大小,斜率越大,反应速率越快,所以是EF段,故答案为:EF;
(2)E→F段反应速率加快,是因为反应放热,溶液温度升高,F→G段反应速率减慢,是因为盐酸浓度降低,故答案为:E→F段溶液温度升高,反应速率加快,F→G,盐酸浓度降低,反应速率减慢;
(3)A.加入蒸馏水,盐酸浓度减小,反应速率减慢,故A正确;
B.加入氯化钠固体,反应物浓度不变,反应速率不变,故B错误;
C.加入NaCl溶液,氢离子浓度减小,反应速率减慢,故C正确;
D.加入浓盐酸,氢离子浓度增大,反应速率加快,故D错误.
故答案为:AC.
点评 本题考查化学反应速率的影响因素,为高频考点,把握温度、浓度对反应速率的影响为解答的关键,注重基础知识的考查,注意图象的分析,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有7个周期,8个主族 | |
| B. | 最外层电子数相同的元素一定在同一族 | |
| C. | 短周期元素中可能有副族元素 | |
| D. | 元素周期表有18个纵行,共16个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
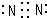 .A的最高价氧化物对应的水化物的电子式
.A的最高价氧化物对应的水化物的电子式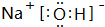 .
.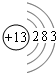 ,X的单质和氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
,X的单质和氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水中含有溴元素,只需经过化学变化就可以得到高纯度的溴 | |
| B. | 海水淡化涉及到了化学变化 | |
| C. | 从海水中可以得到NaCl,除了食用外,还可以用于工业制氯气 | |
| D. | 海水中含有丰富的钠、镁、碘、金 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com