
【题目】按要求回答下列问题:
(1)3-甲基-戊烯的结构简式为___________
(2)某炔的分子式为C4H4它是合成橡胶的中间体,它有多种同分异构体。
①写出它的一种链式结构的同分异构体的结构简式(提示:同一个碳原子上连接2个碳碳双链的结构不稳定)______________
②它有一种同分异构体,每个碳原子均达饱和,且碳与碳的夹角相同,该分子中碳原子形成的空间构型为__________________形
(3)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2消耗氧气6.72L(标准状况下),则该物质的实验式是________
(4)写出由甲苯制TNT的方程式______________________
【答案】CH3CH=C(CH3)CH2CH3 HC=C-CH=CH2 正四面体 C2H6O 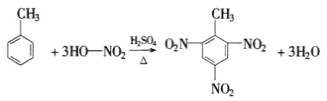
【解析】
(1)根据烯烃的系统命名法推出有机物的结构简式;
(2)①由链式结构可知含双键和三键;
②它的一种同分异构体,每个碳均达饱和,且构成的空间构型中碳与碳间的夹角都相同,则4个C形成正四面体结构;
(3)计算水、二氧化碳、氧气物质的量,根据原子守恒计算分子中C、H、O原子数目之比确定最简式;
(4)甲苯与浓硝酸在浓硫酸、加热条件下可制备TNT。
(1)3-甲基-戊烯的结构简式为CH3CH=C(CH3)CH2CH3,
故答案为:CH3CH=C(CH3)CH2CH3;
(2)①由链式结构,可知含双键和三键,结构简式为HC≡CCH═CH2,
故答案为:HC≡CCH═CH2;
②它的一种同分异构体,每个碳均达饱和,且构成的空间构型中碳与碳间的夹角都相同,则4个C形成正四面体结构结构式为 ,
,
故答案为:正四面体;
(3)5.4g H2O的物质的量=![]() = 0.3 mol,则n(H)=0.6mol,8.8 g CO2的物质的量=
= 0.3 mol,则n(H)=0.6mol,8.8 g CO2的物质的量=![]() =0.2mol,则n(C)=0.2mol,6.72 LO2的物质的量=
=0.2mol,则n(C)=0.2mol,6.72 LO2的物质的量=![]() =0.3mol,由O元素守恒可知有机物中含有n(O) = 0.3mol + 0.2mol×2 0.3mol×2 = 0.1 mol,
=0.3mol,由O元素守恒可知有机物中含有n(O) = 0.3mol + 0.2mol×2 0.3mol×2 = 0.1 mol,
则分子中n(C):n(H):n(O)=2:6:1,故实验式为:C2H6O,
故答案为:C2H6O;
(4)甲苯与浓硝酸,在浓硫酸加热条件下发生取代反应(硝化反应)生成三硝基甲苯,即TNT,其反应的化学方程式为: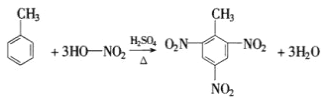 ,
,
故答案为: 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图是实验室制取氯气并以氯气为原料进行特定反应的装置。其中:A中盛有MnO2,B中盛有浓盐酸。

(1)用下列两种方法制取氯气:
①用含HCl146g的浓盐酸与足量的MnO2反应;
②用87gMnO2与足量的浓盐酸反应。不考虑HCl的挥发,
则两种方法生成的氯气的量是方法①___②(填“>”、“<”或“=”)。
(2)仪器B的名称是__。
(3)C中盛饱和食盐水(氯气在其中的溶解度很小),是为了除去氯气中混有的__气体。
(4)仪器D用来干燥氯气,其中盛放的试剂是__。
(5)E中装铁粉,其中发生反应的化学方程式是__。
(6)G中盛有NaOH溶液,目的是___。其中发生反应的离子方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. O2、O3 是氧元素的同素异形体,性质都相似
B. 35Cl与37Cl-互为同位素
C. 乙二醇( ![]() ) 和甘油(
) 和甘油( ![]() )互为同系物
)互为同系物
D. CH3CHO 与![]() 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物结构如图,下列说法中正确的是
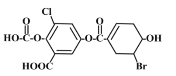
A. 该物质的化学式为C15H12O8BrCl
B. 该物质能与FeCl3溶液发生显色反应
C. 1mol该物质最多能与3mol溴水发生加成反应
D. 一定条件下,1mol该物质最多能与7molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醚是有机合成中常用的溶剂。某实验小组在实验室利用乙醇脱水制备乙醚,装置示意图(夹持和加热装置已略去)、有关数据和实验步骤如下:
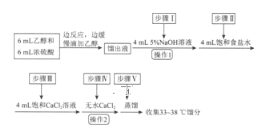

物质 | 相对分子质量 | 密度/(g·mL-1) | 沸点/℃ | 在水中的溶解性 |
乙醇 | 46 | 0.816 | 78 | 互溶 |
乙醚 | 74 | 0.713 | 34.6 | 不溶 |
已知:①相同条件下,乙醚在饱和食盐水中比在水中更难溶。
②氯化钙可与乙醇形成络合物CaCl2·6C2H5OH。
请回答下列问题:
(1)仪器B的名称为________。
(2)由乙醇制备乙醚的总反应为2C2H5OH![]() CH3CH2OCH2CH3+H2O,此反应分两步进行,第一步反应的化学方程式为:CH3CH2OH+H2SO4
CH3CH2OCH2CH3+H2O,此反应分两步进行,第一步反应的化学方程式为:CH3CH2OH+H2SO4![]() CH3CH2OSO2OH+H2O,则第二步反应的化学方程式为_____________。
CH3CH2OSO2OH+H2O,则第二步反应的化学方程式为_____________。
(3)仪器D中盛有冰水混合物,其作用为____________。
(4)操作1的名称为_______________。
(5)若省略步骤Ⅱ会导致的后果是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2mol MnO2和50mL 12mol·L-1盐酸混合后缓慢加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀,物质的量为x mol(不考虑盐酸的挥发),则x的取值范围是
A.x=0.3B.x<0.3C.0.3<x<0.6D.以上结论都不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。
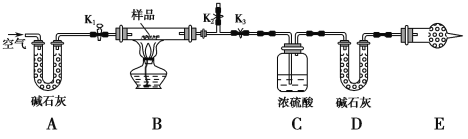
(1) 实验步骤:
① 按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是____________________。
② 称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是___________________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为___________________________、______________________________。
⑤ 打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2) 关于该实验方案,请回答下列问题。
① E处干燥管中盛放的药品是________,其作用是______________________________________,如果实验中没有该装置,则可能导致测量结果NaHCO3的质量分数________(填“偏大”“偏小”或“无影响”)。
② 若样品质量为w g,反应后C、D装置增加的质量分别为m1 g、m2 g,则混合物中Na2CO3·10H2O的质量分数为__________________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于同分异构体(不考虑立体异构)的数目判断正确的是( )
选项 | A | B | C | D |
分子式(或结构简式) | C5H10O2 | C5H10 |
| C7H16 |
已知条件 | 能与碳酸氢钠反应 | 能使溴 水褪色 | 一氯代物 | 分子中含 有3个甲基 |
同分异构体数目 | 4 | 3 | 4 | 5 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种锂钒氧化物热电池装置,电池总反应为xLi+LiV3O8=Li1+xV3O8。工作时,需先引发铁和氯酸钾反应使共晶体熔化,下列说法不正确的是( )
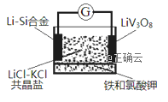
A. 放电时LiV3O8电极反应为:xLi++LiV3O8-xe-=Li1+xV3O8
B. 整个过程的能量转化涉及化学能转化为热能和电能
C. 组装该电池应当在无水、无氧的条件下进行
D. 充电时Cl-移向LiV3O8电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com