
【题目】如图是实验室制取氯气并以氯气为原料进行特定反应的装置。其中:A中盛有MnO2,B中盛有浓盐酸。

(1)用下列两种方法制取氯气:
①用含HCl146g的浓盐酸与足量的MnO2反应;
②用87gMnO2与足量的浓盐酸反应。不考虑HCl的挥发,
则两种方法生成的氯气的量是方法①___②(填“>”、“<”或“=”)。
(2)仪器B的名称是__。
(3)C中盛饱和食盐水(氯气在其中的溶解度很小),是为了除去氯气中混有的__气体。
(4)仪器D用来干燥氯气,其中盛放的试剂是__。
(5)E中装铁粉,其中发生反应的化学方程式是__。
(6)G中盛有NaOH溶液,目的是___。其中发生反应的离子方程式是___。
【答案】< 分液漏斗 HCl 浓硫酸 2Fe+3Cl2=FeCl3 吸收Cl2 Cl2+2OH-=Cl-+ClO-+H2O
【解析】
(1)MnO2与热的浓盐酸发生反应,生成二氯化锰和氯气,反应的方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;当盐酸浓度减小到一定程度时,与MnO2就不能再发生反应。
MnCl2+Cl2↑+2H2O;当盐酸浓度减小到一定程度时,与MnO2就不能再发生反应。
①含HCl146g的浓盐酸与足量的MnO2反应,此时HCl为4mol,生成Cl2小于1mol;
②87gMnO2为1mol,与足量的浓盐酸反应,可生成Cl21mol;
通过前面的计算便可确定两种方法生成氯气的量的大小关系。
(2)仪器B的名称是分液漏斗;
(3)C中盛饱和食盐水(氯气在其中的溶解度很小),是为了除去氯气中混有的HCl气体;
(4)仪器D用来干燥氯气,其中盛放的试剂是液体干燥剂,只能为浓硫酸;
(5)E中装铁粉,发生铁与氯气生成三氯化铁的反应;
(6)G中盛有NaOH溶液,目的是吸收氯气,防止污染环境。
(1)MnO2与热的浓盐酸发生反应,生成二氯化锰和氯气,反应的方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;当盐酸浓度减小到一定程度时,与MnO2就不能再发生反应。
MnCl2+Cl2↑+2H2O;当盐酸浓度减小到一定程度时,与MnO2就不能再发生反应。
①含HCl146g的浓盐酸与足量的MnO2反应,此时HCl为4mol,生成Cl2小于1mol;
②87gMnO2为1mol,与足量的浓盐酸反应,可生成Cl21mol;
则两种方法生成的氯气的量是方法①<②;答案为:<;
(2)仪器B的名称是分液漏斗;答案为:分液漏斗;
(3)C中盛饱和食盐水,因为氯气微溶于饱和食盐水,而氯化氢易溶于饱和食盐水,所以是为了除去氯气中混有的HCl气体;答案为:HCl;
(4)仪器D用来干燥氯气,其中盛放的试剂是液体干燥剂,只能为浓硫酸;答案为:浓硫酸;
(5)E中装铁粉,发生铁与氯气生成三氯化铁的反应,方程式为3Cl2 +2Fe![]() 2FeCl3;
2FeCl3;
答案为:3Cl2 +2Fe![]() 2FeCl3;
2FeCl3;
(6)G中盛有NaOH溶液,目的是吸收氯气,防止污染环境;发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;答案为:吸收Cl2;Cl2+2OH-=Cl-+ClO-+H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】I.配制480 mL 0.2mol/L NaOH溶液。具体如下:
(1)需______gNaOH。
(2)配制过程中,下列仪器不会用到的是__________(填序号),尚缺少的玻璃仪器是______________。
A.托盘天平 B.250mL容量瓶 C.玻璃棒 D.胶头滴管
(3)实验过程中两次用到玻璃棒,其作用分别是:______________、_________。
(4)定容操作:将蒸馏水注入所选的容器中,直到其中液面接近其刻度线____________处时,改用____________滴加蒸馏水至溶液的__________正好与刻度线_______。将瓶塞子盖好,反复____________摇匀。
(5)下列操作的正确顺序是(用字母表示)B→_____→________→______→__________→_____→G。
A.转移 B.称量 C.定容 D.洗涤 E.冷却 F.溶解 G.摇匀
II.乙同学用18.4mol/l浓硫酸配制100ml 3.6mol/L的稀硫酸。
用100 ml 量筒量取20 ml 浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 ml 刻度线,再搅拌均匀。
指出其中错误之处____________________________。
III.在配制一定物质的量浓度溶液时,下列操作出现的后果是(填:“偏低”.“偏高”.“无影响”):
(1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体。_____________。
(2)配制氢氧化钠溶液时,容量瓶中有少量水。______________。
(3)发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度____________。
(4)转移时不慎将溶液倒在瓶外;____________;
(5)定容时俯视容量瓶刻度线:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
A | B | C | D | |
实验 | 制取少量纯净的CO2气体 | 用CCl4提取溴水中的Br2 | 除去CO2中少量的HCl | 蒸干NaCl饱和溶液制备NaCl晶体 |
装置或仪器 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
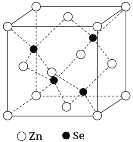
【题目】硒元素(Se)是第4周期ⅥA族元素,单质有红硒、黑硒和灰硒,灰硒是良好的半导体材料,硒最特殊的性质是在光照射下导电性可提高近千倍,可用于制造光电管。请回答下列问题:
(1)基态Se原子价电子的轨道表示式为__。
(2)As和Se是同一周期元素,As的第一电离能比Se大,原因是___。
(3)硒在空气中燃烧能生成SeO2,常温下,SeO2是易挥发的白色固体,熔点为340~350℃,315℃时升华,则SeO2固体是___晶体;写出一种与SeO2互为等电子体的阴离子的化学式__。
(4)H2SeO4和H2SO4相似,是一种不易挥发的强酸。SeO42-的空间构型为___,中心原子的杂化方式为___。
(5)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,Zn原子的配位数为___,若该晶胞密度为ρg·cm-3,硒化锌的摩尔质量为Mg·mol-1,用NA代表阿伏加德罗常数,则晶胞参数a(即晶胞的边长)为___nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是____(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料红氧化铁的工艺流程如下(部分操作和条件略):
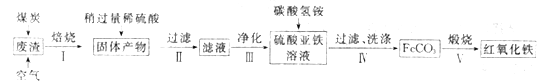
①在步骤Ⅰ中产生的有毒气体可能有_____________________。
②在步骤Ⅲ操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上将Al3+ 沉淀完全,则溶液的pH为_________。(c(Al3+)≤1.0×10-5mol/L 视为Al3+沉淀完全)
③步骤Ⅳ中,生成FeCO3的离子方程式是____________________________。
(3)氯化铁溶液称为化学试剂中的“多面手”。向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生沉淀,写出该沉淀的化学式______________。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释:__________________________________________________________。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应Ⅱ的离子方程式是____________________________________________。
②如今基于普鲁士蓝合成原理可检测食品中是否含CN-,方案如下:
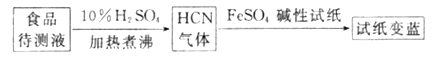
若试纸交蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品香精菠萝酯的生产路线(反应条件略去)如下:

下列叙述错误的是( )
A.步骤(1)产物中残留的苯酚可用FeCl3溶液检验
B.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
C.苯氧乙酸和菠萝酯均可与NaOH溶液发生反应
D.步骤(2)产物中残留的丙烯醇可用溴水检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷和镍均为重要的无机材料,在化工领域具有广泛的应用。
(1)基态As原子的价层电子的电子云轮廓图形状为_____________。与砷同周期的主族元素的基态原子中,第一电离能最大的为_____________(填元素符号。)
(2)Na3AsO3可用于碘的微量分析。
①Na+的焰色反应呈黄色,金属元素能产生焰色反应的微观原因为__________________________。
②Na3AsO3中所含阴离子的立体构型为_____________,写出一种与其互为等电子体的分子:_____________(填化学式)。
(3)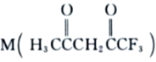 可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含
可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含![]() 键和π键的数目之比为___________。
键和π键的数目之比为___________。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。区分晶体Ni和非晶体Ni的最可靠的科学方法为___________。
(5)某砷镍合金的晶胞结构如下图所示,设阿伏加德罗常数的值为NA,则该晶体的密度ρ=___________g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物与悬浮在大气中海盐粒子的相互反应:4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g) ![]() 在恒温条件下,向2L恒容密闭容器中加入0.4molNO2和0.2molNaCl,10min反应达到平衡时n(NaNO3)=0.1mol,NO2的转化率为
在恒温条件下,向2L恒容密闭容器中加入0.4molNO2和0.2molNaCl,10min反应达到平衡时n(NaNO3)=0.1mol,NO2的转化率为![]() 。下列叙述中正确的是
。下列叙述中正确的是
A. 10min内NO浓度变化表示的速率υ(NO)=0.01mol·L-1·min-1
B. 若升高温度,平衡逆向移动,则该反应的![]()
C. 若起始时向该容器中充入0.1molNO2(g)、0.2molNO(g)和0.1molCl2(g)(固体物质足量),则反应将向逆反应方向进行
D. 若保持其他条件不变,在恒压下进行该反应,则平衡时NO2的转化率小于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)3-甲基-戊烯的结构简式为___________
(2)某炔的分子式为C4H4它是合成橡胶的中间体,它有多种同分异构体。
①写出它的一种链式结构的同分异构体的结构简式(提示:同一个碳原子上连接2个碳碳双链的结构不稳定)______________
②它有一种同分异构体,每个碳原子均达饱和,且碳与碳的夹角相同,该分子中碳原子形成的空间构型为__________________形
(3)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2消耗氧气6.72L(标准状况下),则该物质的实验式是________
(4)写出由甲苯制TNT的方程式______________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com