
【题目】常温下,下列溶液中的粒子浓度关系正确的是
A. NH4C1溶液中:c(Cl-)=c(NH4+)>c(OH-)=c(H+)
B. Na2SO4溶液中:c(Na+) + c(H+)=c(SO42-) + c(OH-)
C. NaHCO3溶液中:c(Na+)> c(HCO3-) >c(CO32-)> c(OH-)
D. 浓度均为0.1mol/LCH3COOH 与CH3COONa溶液等体积混合:c(CH3COO-) + c(CH3COOH)=0.1mol/L
【答案】D
【解析】A. NH4C1溶液中,因铵根离子部分水解,溶液显酸性,则:c(OH-)<c(H+),根据电荷守恒可知c(Cl-)>c(NH4+),则溶液中离子浓度的大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故A错误;B. 在Na2SO4溶液中,根据电荷守恒可得:c(Na+) + c(H+)=2c(SO42-) + c(OH-),故B错误;C. NaHCO3溶液中,碳酸氢根离子的水解程度大于电离程度,溶液呈碱性,则c(CO32-)<c(OH-),溶液中离子浓度的大小关系为:c(Na+)> c(HCO3-) >c(OH-)>c(CO32-) ,故C错误;D. 浓度均为0.1mol/LCH3COOH 与CH3COONa溶液等体积混合,设两溶液的体积均为1L,根据物料守恒可得:c(CH3COO-) + c(CH3COOH) = ![]() =0.1mol/L,故D正确;答案选D。
=0.1mol/L,故D正确;答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染。下列做法不符合绿色化学理念的是( )
A.研制水溶剂涂料替代有机溶剂涂料
B.用可降解塑料生产包装盒或快餐盒
C.用反应:![]() 制备硫酸铜
制备硫酸铜
D.用反应:![]() 制备环氧乙烷
制备环氧乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硝酸锶[Sr(NO3)2]可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
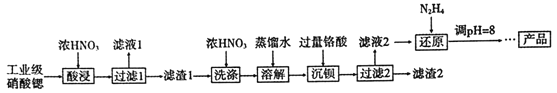
已知: ①“滤液1”的主要溶质是Ca(NO3)2;“滤渣1”的成分为Ba(NO3)2、Sr(NO3)2;“滤渣2”的主要成分为BaCrO4
②铬酸(H2CrO4)为弱酸
(1)“酸浸”不能采用高温的原因是_______。
(2)相对于水洗,用浓HNO3洗涤的优点是_______。
(3)“滤液2”中过量的H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体,写出反应的离子方程式____。
(4)在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq) +3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=1.0×10-32,当c(Cr3+)降至1.0×10-5mol/L,认为Cr3+已经完全沉淀。现将还原后溶液的pH值调至4,此时Cr3+是否沉淀完全? ___( 列式计算)。
Cr3+(aq) +3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=1.0×10-32,当c(Cr3+)降至1.0×10-5mol/L,认为Cr3+已经完全沉淀。现将还原后溶液的pH值调至4,此时Cr3+是否沉淀完全? ___( 列式计算)。
(5)已知Cr(OH)3类似Al(OH)3,还原后溶液的pH不能大于8的原因是_______(结合离子方程式说明理由)。
(6)为了测定“滤渣2”中BaCrO4的含量,进行以下实验:
m g“滤渣2”![]() 溶液
溶液![]() 滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)
滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)
①若加入的HI溶液过量太多,测定结果会_____(填“偏低”、“偏高”或“无影响”)。
②“滤渣2”中BaCrO4(摩尔质量为Mg/mol)的质量分数为_____(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯水的叙述,不正确的是( )
A. 新制的氯水中,溶质既有分子又有离子
B. 新制的氯水是无色透明的液体,有酸性和漂白性
C. 光照氯水有气泡逸出,该气体是O2
D. 氯水放置数天后酸性将增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(主要成分为CuFeS2)是生产铜、铁和硫酸的原料。回答下列问题:
(1)基态Cu原子的价电子排布式为________
(2)从原子结构角度分析,第一电离能I1(Fe)与I1(Cu)的关系是:I1(Fe)____I1(Cu)(填“>“<"或“=”)
(3)血红素是吡咯(C4H5N)的重要衍生物,血红素(含Fe2+)可用于治疗缺铁性贫血。吡略和血红素的结构如下图:
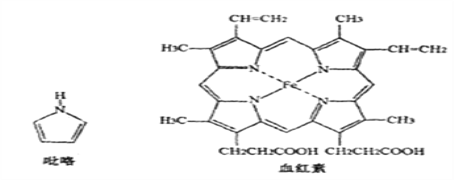
①已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为_______
②1mol吡咯分子中所含的σ键总数为____个。分子中的大π键可用![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡略环中的大π键应表示为_____。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡略环中的大π键应表示为_____。
③C、N、O三种元素的简单氢化物中,沸点由低到高的顺序为________(填化学式)。
④血液中的O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过_____键相结合。
(4)黄铜矿冶炼铜时产生的SO2可经过SO2![]() SO3
SO3![]() H2SO4途径形成酸雨。SO2的空间构 型为________。H2SO4的酸性强于H2SO3的原因是____________
H2SO4途径形成酸雨。SO2的空间构 型为________。H2SO4的酸性强于H2SO3的原因是____________
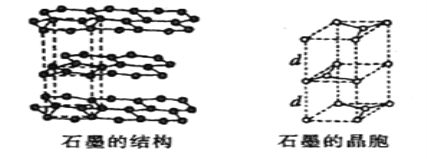
(5)用石墨作电极处理黄铜矿可制得硫酸铜溶液和单质硫。石墨的晶体结构如下图所示,虚线勾勒出的是其晶胞。则石墨晶胞中含碳原子数为____个。已知石墨的密度为ρg/cm3,C-C键的键长为rcm,设阿伏加德罗常数的值为NA,则石墨晶体的层间距d=______cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. MnO2+ 4HCl(浓)![]() MnCl2 +Cl2↑ + 2H2O中,氧化剂和还原剂物质的量之比为1∶4
MnCl2 +Cl2↑ + 2H2O中,氧化剂和还原剂物质的量之比为1∶4
B. 2H2S+ SO2=3S+2H2O中,氧化产物和还原产物物质的量之比为1∶1
C. 3S+ 6KOH=2K2S+ K2SO3+3H2O中,被氧化和被还原的硫元素物质的量之比为2∶1
D. Al2O3+N2+3C![]() 2AlN+3CO中,氧化剂和还原剂物质的量之比为1∶3
2AlN+3CO中,氧化剂和还原剂物质的量之比为1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 32 g S8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
B. 2 g由H218O和2H2O组成的物质中含有的质子数为NA
C. 14 g乙烯和丙烯的混合物完全燃烧时,产生的CO2分子数目为NA
D. 15 g 甲基中所含的电子数为10NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com