
(16分)磷及其化合物在生产、生活中有重要的用途。回答下列问题:
(1)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。
①写出磷酸主要的电离方程式: 。
②n越大,直链聚磷酸铵的水溶性越 (填“大”或“小”)。
(2)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式。

(3)由工业白磷 (含少量砷、铁、镁等) 制备高纯白磷 ( 熔点44℃,沸点280℃),主要生产流程如下:

①除砷过程在75 ℃下进行,其合理的原因是 (填字母)。
a.使白磷熔化,提高反应活性
b.降低白磷的毒性
c.温度不宜过高,防止硝酸分解
d.适当提高温度,增大反应速率
②生产过程在高纯氮气保护下进行,其目的是 。
③除砷过程中,合成洗涤剂起到 作用。
④硝酸氧化除砷时被还原为NO,写出砷转化为砷酸的化学方程式: 。
氧化相同质量的砷,当转化为亚砷酸的量越多,消耗硝酸的量越 (填“多”或“少”)。
⑤某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如图,砷的脱除率从a点到b点降低的原因是 。

(1)①H3PO4 H++H2PO4-(2分);②小(1分);(2)1,4,6OH-,1,4,4H2O(2分);
H++H2PO4-(2分);②小(1分);(2)1,4,6OH-,1,4,4H2O(2分);
(3)①acd(2分);②防止白磷被空气中氧气氧化(2分);③乳化(2分);
④3As+5HNO3+2H2O=3H3AsO4+5NO↑(2分),少(1分);
⑤硝酸浓度变大,氧化性增强,有较多的硝酸用于氧化白磷,脱砷率降低(2分)。
【解析】
试题分析:(1)①H3PO4是三元弱酸,其电离是逐步进行的,主要是第一步电离,磷酸主要的电离方程式是H3PO4 H++H2PO4-;②在磷酸通过分子间脱水形成直链聚磷酸中,n越大,分子中含有的羟基就越少,得到的直链聚磷酸铵的水溶性越小;(2)该反应是氧化还原反应,同时也是离子反应,根据电子守恒、电荷守恒及原子守恒,可得反应的方程式是:H2PO2-+4Ag++6OH-=PO43-+4Ag+4H2O。(3) ①除砷过程在75 ℃下进行,其合理的原因是使白磷熔化,提高反应活性;适当提高温度,增大反应速率;温度不宜过高,防止硝酸分解,所以选项是acd。②生产过程在高纯氮气保护下进行,原因是白磷非常活泼,容易与空气中的氧气发生反应;在氮气的环境中,其目的是防止白磷被空气中氧气氧化;③除砷过程中,合成洗涤剂起到乳化作用。④硝酸氧化除砷时被还原为NO,砷被氧化为砷酸,根据电子守恒、原子守恒,可得砷转化为砷酸的化学方程式:3As+5HNO3+2H2O=3H3AsO4+5NO↑;氧化相同质量的砷,当转化为亚砷酸的量越多,得到的电子就越少,则反应消耗硝酸的量越少;⑤根据图示可知,砷的脱除率从a点到b点降低,原因是硝酸浓度变大,氧化性增强,有较多的硝酸用于氧化白磷,脱砷率降低。
H++H2PO4-;②在磷酸通过分子间脱水形成直链聚磷酸中,n越大,分子中含有的羟基就越少,得到的直链聚磷酸铵的水溶性越小;(2)该反应是氧化还原反应,同时也是离子反应,根据电子守恒、电荷守恒及原子守恒,可得反应的方程式是:H2PO2-+4Ag++6OH-=PO43-+4Ag+4H2O。(3) ①除砷过程在75 ℃下进行,其合理的原因是使白磷熔化,提高反应活性;适当提高温度,增大反应速率;温度不宜过高,防止硝酸分解,所以选项是acd。②生产过程在高纯氮气保护下进行,原因是白磷非常活泼,容易与空气中的氧气发生反应;在氮气的环境中,其目的是防止白磷被空气中氧气氧化;③除砷过程中,合成洗涤剂起到乳化作用。④硝酸氧化除砷时被还原为NO,砷被氧化为砷酸,根据电子守恒、原子守恒,可得砷转化为砷酸的化学方程式:3As+5HNO3+2H2O=3H3AsO4+5NO↑;氧化相同质量的砷,当转化为亚砷酸的量越多,得到的电子就越少,则反应消耗硝酸的量越少;⑤根据图示可知,砷的脱除率从a点到b点降低,原因是硝酸浓度变大,氧化性增强,有较多的硝酸用于氧化白磷,脱砷率降低。
考点:考查弱酸的电离方程式的书写、氧化还原反应方程式的书写、反应条件的控制、物质反应量多少与物质浓度的关系的分析的知识。
考点分析: 考点1:氧化还原反应 考点2:弱电解质的电离 考点3:物质的制备 考点4:氮族元素 试题属性

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期第一次月考理综化学试卷(解析版) 题型:选择题
某100mL混合酸中,HNO3物质的量浓度为0.4mol/L,H2SO4物质的量浓度为0.2mol/L。向其中加入2.56gCu粉,待充分反应后(反应前后溶液体积变化忽略不计),溶液中Cu2+物质的量浓度为
A.0.15mol/L B.0.3mol/L C.0.225mol/L D.无法计算
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省湛江市高三高考测试(一)理综化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.电解饱和食盐水能制得NaOH
B.澄清石灰水能鉴别Na2CO3和NaHCO3
C.配制溶液,定容时俯视容量瓶刻度会使溶液浓度偏低
D.铁粉中混入少量铝粉,可加入过量的氨水后过滤除去
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省、广雅中学、佛山一中高三联考理综化学试卷(解析版) 题型:实验题
(16分)硅孔雀石是一种含铜的矿石,含铜形态为CuCO3Cu(OH)2和CuSiO32H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下:

(1)步骤①中稀硫酸与CuSiO3·2H2O发生反应的化学方程式: ;
用离子方程式表示双氧水的作用_______________________________________。
(2)步骤②调节溶液pH选用试剂不可以是__________________
a.CuO b.Cu (OH)2 c.Cu2(OH)2CO3 d.CuSO4
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
由上表可知当溶液pH=4时,可以完全除去的离子是______(填金属离子符号,后同),不能完全除去的离子是________。
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶、洗涤可以得到CuSO45H2O晶体。某同学认为上述操作会有硫酸铝晶体析出。请你结合相关数据,通过计算对该同学的观点予以评价 (填“正确”、“不正确”、或“无法判断”)
【已知常温下,Al2(SO4)3饱和溶液中c(Al3+)=2.25mol/L,Ksp[Al(OH)3]=3.2×10-34】
(5)测定硫酸铜晶体(CuSO45H2O)里结晶水的含量,实验步骤为:a.研磨;b.称量空坩埚和装有试样的坩埚的质量;c.灼烧;d.干燥器中冷却;e.称量;f.重复c至e的操作,直到连续两次称量的质量差不超过0.1g为止;⑦根据实验数据计算硫酸铜结晶水的含量。
①步骤c用到的仪器有酒精灯、三脚架、泥三角、玻璃棒、 、 。
②步骤f的目的是 。
③如灼烧后在空气中冷却再称量,结晶水的测定结果会____(填“偏高”、“低”或“不变”)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省、广雅中学、佛山一中高三联考理综化学试卷(解析版) 题型:选择题
下列实验设计正确且能达到目的的是

A.装置①配制一定的物质的量浓度的稀硫酸溶液
B.装置②根据溶液褪色的快慢比较浓度对反应速率的影响
C.装置③制作原电池
D.装置④制备硅胶
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三质量检测化学试卷(解析版) 题型:选择题
往含Cl-和I-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示。下列说法正确的是
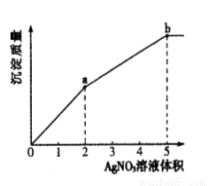
A.KSP (AgCl) < KSP (AgI)
B.c( Cl- ) :c( I-) = 3 :2
C.m( AgCl ) :m( AgI ) = 2 :3
D.a~b段产生黄色沉淀
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三质量检测化学试卷(解析版) 题型:选择题
下列反应的离子方程式正确的是
A.二氧化锰和浓盐酸制取氯气:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B.碳酸钠溶液用作洗涤剂的原理:CO32-+2H2O H2CO3+2OH-
H2CO3+2OH-
C.用氯化铁溶液与铜反应制作印刷电路板:Fe3++Cu=Fe2++Cu2+
D.氯化铝溶液与氨水制取氢氧化铝:Al3+ + 3OH- ==Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源:2015年期中备考总动员高三化学模拟卷【福建】3(解析版) 题型:选择题
【改编】列与有机物的结构.性质有关的叙述正确的是
A.乙烯通入酸性KMn04溶液中,紫色褪去,是因为发生了加成反应
B.糖类、油脂、蛋白质都属于天然高分子化合物
C.葡萄糖.果糖的分子式均为C6H12O6,二者互为同分异构体
D.可用热的NaOH溶液除去乙酸乙酯中的乙酸杂质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省高三第三次四校联考理综化学试卷(解析版) 题型:填空题
选考[化学---选修3:物质结构与性质] (15分)
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)铟与镓同是IIIA族元素,写出铟基态原子的电子排布式: 。
(2)硒为第四周期VIA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由小到大的顺序为 。(用元素符号表示)
(3)SeO3分子的立体构型为 。
(4)硅烷(SinH2n+2)的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是 。

(5)硼元素具有缺电子性,其化合物往往具有加合性,如硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-,其中B原子的杂化类型为 。
(6)金属铜投入氨水中或投入H2O2溶液中均无明显现象,但投入氨水—过氧化氢混合液中,则铜片溶解,溶液呈深蓝色,写出该反应的离子方程式: 。
(7)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为 ;若该晶体的晶胞参数为a pm,则该合金密度为 g/cm3。(列出计算式,不要求计算结果,阿伏伽德罗数的值为NA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com