
下列反应的离子方程式正确的是
A.二氧化锰和浓盐酸制取氯气:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B.碳酸钠溶液用作洗涤剂的原理:CO32-+2H2O H2CO3+2OH-
H2CO3+2OH-
C.用氯化铁溶液与铜反应制作印刷电路板:Fe3++Cu=Fe2++Cu2+
D.氯化铝溶液与氨水制取氢氧化铝:Al3+ + 3OH- ==Al(OH)3↓
A
【解析】
试题分析:A.二氧化锰和浓盐酸制取氯气:MnO2+4H++2Cl-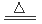 Mn2++Cl2↑+2H2O,方程式符合事实,拆写无误,正确;B.碳酸钠溶液用作洗涤剂的原理,是由于CO32-发生水解反应,但是水解是逐步进行的:CO32-+2H2O
Mn2++Cl2↑+2H2O,方程式符合事实,拆写无误,正确;B.碳酸钠溶液用作洗涤剂的原理,是由于CO32-发生水解反应,但是水解是逐步进行的:CO32-+2H2O HCO3-+OH-,错误;C.用氯化铁溶液与铜反应制作印刷电路板,发生氧化还原反应,根据电子守恒、电荷守恒、原子守恒,可得:2Fe3++Cu=2Fe2++Cu2+;错误;D.氯化铝溶液与氨水制取氢氧化铝,一水合氨是弱酸,不能写成离子形式,离子方程式是:Al3+ + 3NH3H2O== Al(OH)3↓ +3NH4+,错误。
HCO3-+OH-,错误;C.用氯化铁溶液与铜反应制作印刷电路板,发生氧化还原反应,根据电子守恒、电荷守恒、原子守恒,可得:2Fe3++Cu=2Fe2++Cu2+;错误;D.氯化铝溶液与氨水制取氢氧化铝,一水合氨是弱酸,不能写成离子形式,离子方程式是:Al3+ + 3NH3H2O== Al(OH)3↓ +3NH4+,错误。
考点:考查离子方程式的正误判断的知识。
考点分析: 考点1:离子方程式 试题属性

科目:高中化学 来源:2014-2015学年辽宁省高三下学期初考试理综化学试卷(解析版) 题型:选择题
下列关于阿佛加德罗常数的说法正确的是
A.0.1 NA的NO在一密闭容器中与足量氧气完全反应,得到0.1 mol NO2
B.一定条件下的密闭容器中,6.4 g SO2可被氧气氧化得到SO3的分子数为0.1 NA
C.常温下18 g铝放入足量浓硫酸中转移电子数2 NA
D.1 L 0.1 mol/L FeCl3溶液完全水解得到的Fe(OH)3胶体微粒数小于0.1 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省汕头市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.乙醇与乙酸都存在碳氧双键
B.油脂水解可得到氨基酸和甘油
C.淀粉和纤维素水解最终产物都是葡萄糖
D.卤代烃加入硝酸酸化的硝酸银溶液可根据生成的卤化银沉淀颜色检验卤原子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三质量检测化学试卷(解析版) 题型:填空题
(16分)磷及其化合物在生产、生活中有重要的用途。回答下列问题:
(1)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。
①写出磷酸主要的电离方程式: 。
②n越大,直链聚磷酸铵的水溶性越 (填“大”或“小”)。
(2)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式。

(3)由工业白磷 (含少量砷、铁、镁等) 制备高纯白磷 ( 熔点44℃,沸点280℃),主要生产流程如下:

①除砷过程在75 ℃下进行,其合理的原因是 (填字母)。
a.使白磷熔化,提高反应活性
b.降低白磷的毒性
c.温度不宜过高,防止硝酸分解
d.适当提高温度,增大反应速率
②生产过程在高纯氮气保护下进行,其目的是 。
③除砷过程中,合成洗涤剂起到 作用。
④硝酸氧化除砷时被还原为NO,写出砷转化为砷酸的化学方程式: 。
氧化相同质量的砷,当转化为亚砷酸的量越多,消耗硝酸的量越 (填“多”或“少”)。
⑤某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如图,砷的脱除率从a点到b点降低的原因是 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三质量检测化学试卷(解析版) 题型:选择题
汽车尾气净化中的一个反应如下:NO(g)+CO(g)=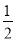 N2(g)+CO2(g) ΔH=-373.4KJ/mol
N2(g)+CO2(g) ΔH=-373.4KJ/mol
若反应在恒容的密闭容器中达到平衡状态,下列有关说法正确的是
A.其它条件不变,加入催化剂,ΔH变大
B.及时除去二氧化碳,正反应速率加快
C.降低温度,可提高反应物的转化率
D.若气体的密度保持不变,说明平衡不发生移动
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三质量检测化学试卷(解析版) 题型:选择题
2015年世界环境日宣传标语:“减少污染———行动起来”。下列做法正确的是
A.为提高农作物的产量,大量使用化肥和农药
B.绿色化学的核心是对环境污染进行治理
C.为防止食品变质,加入大量的防腐剂
D.垃圾是放错地方的资源,进行分类回收处理
查看答案和解析>>
科目:高中化学 来源:2015年期中备考总动员高三化学模拟卷【福建】3(解析版) 题型:选择题
【改编】W、X、Y、Z四种短周期元素。已知X原子的核外电子数和Ne原子相差1,在同周期中X原子半径最大,W、Y、Z在周期表中的相对位置如图,Z的非金属性在同周期元素中最强。下列说法正确的是
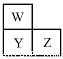
A.原子半径大小比较:Z>Y>W>X
B.Z能够形成HZO3型化合物
C.W与X形成的化合物只含有离子键
D.W、X、Z只能形成一种化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省青岛市高三下学期一模考试理综化学试卷(解析版) 题型:选择题
下列有关原子结构、元素性质的说法正确的是
A.Si、P、S、Cl元素的单质与氢气化合越来越容易
B.元素原子最外层电子数越多,元素金属性越强
C.元素周期表共有18列,第3列是第ⅠB族,第17列是第ⅦA族
D.F﹣、O2﹣、Mg2+、Na+离子半径逐渐减小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市三校高三下学期3月质量检测化学试卷(解析版) 题型:实验题
B.草酸二乙酯可用于苯巴比妥等药物的中间体,实验室以草酸(HOOC—COOH)和乙醇为原料制备草酸二乙酯的实验步骤如下:

步骤1:在上图所示装置中,加入无水草酸45g,无水乙醇81g,苯200mL,浓硫酸10mL,搅拌下加热6870℃回流共沸脱水。
步骤2:待水基本蒸完后,分离出乙醇和苯。
步骤3:所得混合液冷却后依次用水、饱和碳酸氢钠溶液洗涤,再用无水硫酸钠干燥。
步骤4:常压蒸馏,收集182-184℃的馏分,得草酸二乙酯57g。
(1)步骤1中发生反应的化学方程式是 ,反应过程中冷凝水应从 (填“a”或“b”)端进入。
(2)步骤2操作为 。
(3)步骤3用饱和碳酸氢钠溶液洗涤的目的是 。
(4)步骤4除抽气减压装置外所用玻璃仪器有蒸馏烧瓶、冷凝管、接液管、锥形瓶和 。
(5)本实验中,草酸二乙酯的产率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com