
某兴趣小组的同学共同设置了如图所示的实验装置,既可用于制取气体又可用于验证物质的性质。请回答下列问题:
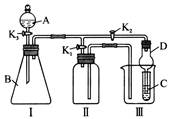
(1)利用装置Ⅰ制取气体,生成气体的反应应具备的条件是 。
(2)利用装置Ⅰ、Ⅱ制取气体(K2关闭,K1打开)。甲同学认为:利用装置Ⅱ可以收集H2、NH3等气体,但不能收集O2和NO等气体,其理由是:
_______________________________________________________________________;
乙同学认为:对装置Ⅱ做简易改进(不改变仪器装置),也可收集O2和NO等气体,但不能收集NO2气体,改进的方法是 ;不能收集NO2气体的原因是(用化学方程式表示) ;
(3)利用装置Ⅰ、Ⅲ 验证物质的性质(K2打开,K1关闭)。如要设计实验证明氧化性
KMnO4>Cl2>Br2,则可在A 中加浓盐酸,B中加 ,C中加 ,观察到C中的现象是 。
〔(1)(2)两空每空2分;(3)每空1分〕(1)固+液反应,不需加热
(2)O2的密度比空气大; NO密度与空气相近,且NO易与O2反应 。
在装置Ⅱ中加满水 ; NO2能与H2O发生反应 (3)KMnO4固体 ;NaBr溶液 ;溶液变橙色 。
【解析】
试题分析:(1)根据装置的特点可知,装置Ⅰ适用于制备固+液反应,且不需加热的气体的制备。
(2)甲同学:O2的密度大于空气的密度,所以氧气应采用向上排空气法收集;一氧化氮和氧气能发生反应生成二氧化氮,一氧化氮应采用排水法收集,所以该装置不能收集氧气和一氧化氮。
乙同学:二氧化氮和水能发生反应,不能采用排水法收集,二氧化氮的密度大于空气的密度,所以应采用排难挥发的有机溶剂或向上排空气法收集;该装置不改变仪器装置,所以只能采用排难挥发的有机溶剂法收集。
(3)根据氧化剂+还原剂=氧化产物+还原产物,氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物,因此要证明氧化性:KMnO4>Cl2>Br2,可将KMnO4作为氧化剂和盐酸反应判断是否生成氯气,如氯气氧化性大于Br2,则将氯气通入NaBr溶液中,如果溶液变为橙红色,说明有Br2生成,从而确定氧化性:KMnO4>Cl2>Br2。
考点:考查常见气体的制备、收集以及氧化还原反应的有关应用
点评:该题是高考中的常见题型,属于基础性试题的考查。试题贴近高考,侧重对学生实验能力的培养,本题要注意根据气体的性质及密度选择相应的收集方法以及实验设计的方案的设计。该题试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。


科目:高中化学 来源: 题型:
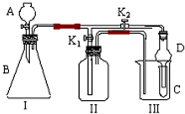 某兴趣小组同学共同设计了如图所示的多功能实验装置.该装置既可用于制取气体,又可用于验证物质的性质.
某兴趣小组同学共同设计了如图所示的多功能实验装置.该装置既可用于制取气体,又可用于验证物质的性质.查看答案和解析>>
科目:高中化学 来源:101网校同步练习 高三化学 山东科学技术出版社 鲁教版 题型:022
某兴趣小组的同学们共同设计了下图所示的实验装置,此装置既可用于制取气体,又可用于验证物质的某些性质.
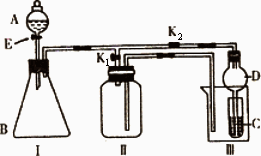
(1)若利用该装置制取并收集H2或NH3,在I中加入药品后应该进行的操作是________;若要制取并收集O2或NO,更换Ⅰ中药品后,不更换仪器,只需要作简单改进,即可完成实验,其改进的方法是________.
(2)打开K2,关闭K1.
①利用该装置进行实验,可以证明以下物质的酸性强弱顺序为:HCl>H2CO3>H2SiO3.
有同学认为:在A中加________,B中加CaCO3,C中加________(均填写物质的化学式).观察到________的现象,即可证明.但有的同学认为此实验证明酸性H2CO3>H2SiO3时有缺陷,你认为缺陷是________.
②利用该装置可以制取Cl2,并在70℃时与NaOH溶液反应生成NaClO和NaClO3.
实验方案是:在A中加浓盐酸,B中加高锰酸钾,C中加氢氧化钠溶液,烧杯中加________.
待C中溶液恰好反应后,向其中加入过量KI溶液,加入醋酸调节溶液的酸性,此时只有NaClO被还原,然后用一定浓度的Na2S2O3溶液滴定;继续向其中加入盐酸,调节溶液的酸性,此时NaClO3被还原,再用同浓度的Na2S2O3溶液滴定.(![]()
![]() )实验结果记录如下:
)实验结果记录如下:

试通过表中数据计算C溶液中生成的ClO-和![]() 的物质的量之比________.
的物质的量之比________.
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组的同学共同设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质。
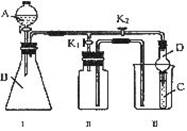
(1)能用Ⅰ装置制取,用Ⅱ装置收集的气体(K2关闭,K1打开)(写出一种即可) ;有关化学反应方程式为: 。
能用Ⅰ装置制取,不能用Ⅱ装置收集的气体(K2关闭,K1打开)(写出一种即可) ;若收集该气体,需对Ⅱ进行怎样的改进? 。
(2)利用Ⅰ、Ⅲ装置验证物质的性质(K2打开,K1关闭)。
已知浓![]() 与次氯酸钙能反应:
与次氯酸钙能反应:![]() 。甲同学想证明氧化性:
。甲同学想证明氧化性:![]() ,则在A中加浓盐酸,B中加
,则在A中加浓盐酸,B中加![]() ,C中加 ,观察到C中的现象是 ;
,C中加 ,观察到C中的现象是 ;
从环境保护的观点考虑,此装置有何不足? ,应怎样改进? ;
画出实验室中通常进行此操作的装置图: 。
乙同学利用此装置制取乙炔气体,将其通入C中验证性质。若C中装有酸性![]() 溶液,其现象为 ;若C中装有溴水,则乙炔与溴水反应的产物为(写结构简式) 。
溶液,其现象为 ;若C中装有溴水,则乙炔与溴水反应的产物为(写结构简式) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组的同学们共同设计了下图所示的实验装置,此装置即可用于制取气体,又可用于验证物质的某些性质。
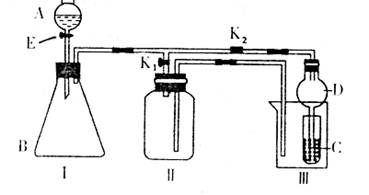
(1)若利用该装置制取并收集H2或NH3,在I中加入药品后应该进行的操作是
;若要制取并收集O2或NO,更换I中药品后,不更换仪器,只需要作简单改进,即可完成实验,其改进的方法是
。
(2)打开K2,关闭K1。
①利用该装置进行实验,可以证明以下物质的酸性强弱顺序为:HC1>H2CO3>H2SiO3。有同学认为:在A中加 ,B中加CaCO3,C中加 (均填写物质的化学式)。观察到 的现象,即可证明。但有的同学认为此实验在证明酸性H2CO3>H2SiO3时有缺陷,你认为缺陷是 。
②利用该装置可以制取C12,并在70℃时与NaOH溶液反应生成NaC1O和NaC1O3。实验方案是:在A中加浓盐酸,B中加高锰酸钾,C中加氢氧化钠溶液,烧杯中加 。待C中溶液恰好反应后,向其中加入过量KI溶液,加入醋酸调节溶液的酸性,此时只有NaC1O被还原,然后用一定浓度的Na2S2O3溶液滴定;继续向其中加入盐酸,调节溶液的酸性,此时NaC1O3被还原,再用同浓度的Na2S2O3溶液滴定。(I2+2S2O32―=S4O62―+2I―)实验结果记录如下:
| 将KI转化为I2 | 滴定I2,消耗Na2S2O3溶液的体积 |
| KI | 5.00mL |
| KI | 30.00mL |
通过表中数据计算C溶液中生成C1O―和C1O3―的物质的量之比 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com