
【题目】亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似.相关转化关系如图所示,下列说法不正确的是( )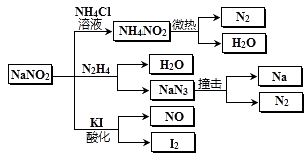
A.NaNO2在水中的溶解性大于NH4NO2
B.NaNO2与N2H4反应中,NaNO2是氧化剂
C.可用淀粉碘化钾试纸和食醋鉴别NaCl与NaNO2
D.NaN3分解,每产生1molN2转移6mol e-
【答案】D
【解析】解:A.NaNO2在氯化铵溶液中能生成NH4NO2 , 说明NaNO2在水中的溶解性大于NH4NO2 , 故A正确;
B.NaNO2与N2H4反应生成NaN3 , NaNO2是中氮的化合价由+3价降低为﹣ ![]() ,是氧化剂,故B正确;
,是氧化剂,故B正确;
C.NaNO2具有氧化性,在酸性条件下氧化碘化钾,得到单质碘,单质碘遇淀粉溶液变蓝,NaCl无氧化性,在酸性条件下不能氧化碘化钾,所以可用淀粉碘化钾试纸和食醋鉴别NaCl与NaNO2 , 故C正确;
D.NaN3中氮的化合价为﹣ ![]() ,生成1个N2转移
,生成1个N2转移 ![]() 个电子,则每产生1 mol N2转移
个电子,则每产生1 mol N2转移 ![]() mole﹣ , 故D错误;
mole﹣ , 故D错误;
故选D.
A.NaNO2在氯化铵溶液中能生成NH4NO2 , 说明NaNO2在水中的溶解性大于NH4NO2;
B.根据氧化剂是化合价升高的反应物;
C.根据信息可知:NaNO2具有氧化性,在酸性条件下氧化碘化钾,得到单质碘,单质碘遇淀粉溶液变蓝,而NaCl无氧化性;
D.根据NaN3中氮的化合价为﹣ ![]() ,生成1个 N2转移
,生成1个 N2转移 ![]() 个电子.
个电子.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.原子晶体中只存在非极性共价键
B.干冰升华时,分子内共价键会发生断裂
C.由原子构成的晶体可以是原子晶体,也可以是分子晶体
D.只要含有金属阳离子的晶体就一定是离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统的引爆炸药由于其中含Pb,使用时将产生污染,同时其引爆后的剩余炸药还严重危害接触者的人身安全,美国UNC化学教授Thomas J·Meyer等研发了环境友好、安全型的“绿色”引爆炸药,其中一种可表示为Na2R,爆炸后不会产生危害性残留物。已知10 mL Na2R溶液含Na+的微粒数为N个,该Na2R溶液的物质的量浓度为( )
A. N×10-2 mol·L-1 B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是( )
A.水玻璃中通入过量二氧化碳:Na2SiO3+CO2+H2O═2Na++CO ![]() +H2SiO3
+H2SiO3
B.澄清石灰水中通入过量二氧化碳:Ca(OH)2+2CO2═Ca2++2HCO ![]()
C.硅与氢氟酸的反应:Si+4H++4F﹣═SiF4↑+2H2↑
D.二氧化硅溶于烧碱溶液中:SiO2+2OH﹣═SiO ![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】建筑工地常用的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:
![]() NaNO2+
NaNO2+![]() HI―→
HI―→![]() NO↑+
NO↑+![]() I2+
I2+![]() NaI+
NaI+![]() H2O
H2O
(1)配平上面方程式。_________
(2)上述反应的氧化剂是________;若有 1 mol 的还原剂被氧化,则反应中转移电子的数目是________。
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①水 ②碘化钾淀粉试纸 ③淀粉 ④白酒 ⑤食醋,进行实验,下列选项合适的是________(填字母)。
A.③⑤ B.①②④
C.①②⑤ D.①②③⑤
(4)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,采用NH4Cl,能使NaNO2转化为不引起二次污染的N2,反应的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述中不正确的是
A. 漂白粉的有效成分是次氯酸钙
B. 碱性氧化物都是金属氧化物,酸性氧化物不一定是非金属氧化物
C. 碳酸、纯碱、石灰石、生石灰是按酸、碱、盐、氧化物分类顺序排列的
D. 依照阿伏加德罗定律,同温同压下两种气体的摩尔质量之比等于密度之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.分别测等浓度的醋酸和氨水pH,发现二者的pH 之和为14,说明常温下醋酸和氨水的电离平衡常数相等
B.将CH3COONa溶液从25℃升温至 40℃,溶液中 ![]() 增大
增大
C.向硝酸中加入氨水至中性,溶液中 ![]() <1
<1
D.向AgCl、AgBr 的饱和溶液中加入少量 AgNO3 , 溶液中 ![]() 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com