
【题目】建筑工地常用的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:
![]() NaNO2+
NaNO2+![]() HI―→
HI―→![]() NO↑+
NO↑+![]() I2+
I2+![]() NaI+
NaI+![]() H2O
H2O
(1)配平上面方程式。_________
(2)上述反应的氧化剂是________;若有 1 mol 的还原剂被氧化,则反应中转移电子的数目是________。
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①水 ②碘化钾淀粉试纸 ③淀粉 ④白酒 ⑤食醋,进行实验,下列选项合适的是________(填字母)。
A.③⑤ B.①②④
C.①②⑤ D.①②③⑤
(4)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,采用NH4Cl,能使NaNO2转化为不引起二次污染的N2,反应的化学方程式为_________________________。
【答案】 2 4 2 1 2 2 NaNO2 6.02×1023 C NaNO2+NH4Cl===NaCl+N2↑+2H2O
【解析】(1)在该反应中NaNO2中的N元素化合价降低1价生成NO,HI中I元素化合价升高1价生成I2,另有一部分生成NaI,所以配平后的方程式为2NaNO2+4HI=2NO↑+I2+2NaI+2H2O;
(2) 反应中NaNO2中的N元素化合价降低,NaNO2作氧化剂,HI中I元素化合价升高,HI作还原剂,所以有1 mol HI被氧化,则转移电子的数目是为NA或6.02×1023;
(3)根据上述反应可知,在酸性条件下,NO2—可把I—氧化生成I2,而Cl—没有氧化性,不能与I—反应,又I2遇淀粉显蓝色,因此可用①②⑤进行实验来鉴别NaNO2和NaCl,所以正确选项为C;
(4)根据叙述可知,反应物为NaNO2和NH4Cl,生成物为N2,结合质量守恒可推知还有NaCl和H2O,所以反应的化学方程式为NaNO2+NH4Cl==NaCl+N2↑+2H2O。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)纯水在T℃时,pH=6,该温度下1molL﹣1的NaOH溶液中,由水电离出的c(OH﹣)=molL﹣1 .
(2)某一元弱酸溶液(A)与二元强酸(B)的pH相等.若将两溶液稀释相同的倍数后,pH(A)pH(B) (填“>”、“=”或“<”).现用上述稀释溶液中和等浓度等体积的NaOH溶液,则需稀释溶液的体积V(A)V(B)(填“>”、“=”或“<”).
(3)已知:二元酸H2R 的电离方程式是:H2R=H++HR﹣ , HR﹣R2﹣+H+ , 若0.1molL﹣1NaHR溶液的c(H+)=a molL﹣1 , 则0.1molL﹣1H2R溶液中c(H+)(0.1+a) molL﹣1(填“<”、“>”或“=”),理由是 .
(4)电离平衡常数是衡量弱电解质电离程度的物理量.已知:
化学式 | 电离常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×10﹣7、K2=5.6×10﹣11 |
①25℃时,有等浓度的HCN溶液、H2CO3溶液和CH3COOH溶液,三溶液的pH由大到小的顺序为(用化学式表示).
②向NaCN溶液中通入少量的CO2 , 发生反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在科研和生产中有广泛应用: 
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g)═TaI4(g)+S2(g)△H>0 ( I)
①该反应的平衡常数表达式K=;
②若K=1,向某恒容密闭容器中加入1.0mol I2(g)和足量TaS2(s),则I2(g)的平衡转化率为 .
(2)如图所示,反应( I)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1T2(填“>”“<”或“=”).上述反应体系中循环使用的物质是 .
(3)利用I2的氧化性可测定钢铁中硫的含量.做法是将钢样中的硫转化为 H2SO3 , 然后用一定浓度的I2溶液进行滴定,所用指示剂为 , 滴定反应的离子方程式为 .
(4)25°C时,将a molL﹣1的氨水与b molL﹣1的盐酸等体积混合,所得溶液的pH=7,则c(NH4+)c(Cl﹣);ab.(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学的一个原则是“原子经济”,最理想的“原子经济”是全部反应物的原子嵌入期望的产物中。在下列反应类型中,“原子经济”程度最低的是( )
A. 化合反应B. 取代反应C. 加成反应D. 加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2.4molA和1.2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应A(g)+B(g)x C(g)+D(g)△H<0,2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于2min内v(B)= .
(2)A的转化率为 .
(3)该反应达到平衡时,再向容器中加入1.2molA和0.6molB,再次达到平衡后,A的转化率(填“增大”、“减小”或“不变”).
(4)该反应的平衡常数的表达式k= , 450℃时平衡常数500℃时平衡常数(填“大于”、“小于”或“等于”).
(5)相同温度下,若起始时向该容器中充入0.4mol A、0.4mol B、0.2molC和0.2molD,反应达到平衡前,反应速率v正v逆(填“>”或“<”),达到平衡时D的浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似.相关转化关系如图所示,下列说法不正确的是( )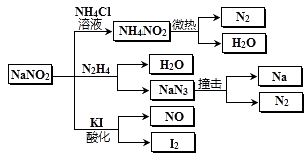
A.NaNO2在水中的溶解性大于NH4NO2
B.NaNO2与N2H4反应中,NaNO2是氧化剂
C.可用淀粉碘化钾试纸和食醋鉴别NaCl与NaNO2
D.NaN3分解,每产生1molN2转移6mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一小段镁带投入盛有稀盐酸的试管中,发生剧烈反应.一段时间后,用手触摸试管外壁感觉烫手.这个实验事实说明该反应( )
A.为放热反应
B.为吸热反应
C.反应过程中热能转化为化学能
D.反应物的总能量低于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不反应的是( ) ①C6H5Cl ②(CH3)2CHCH2Cl ③(CH3)3CCH2Cl ④CHCl2﹣CHBr2 ⑤ ![]() ⑥CH2Cl2 .
⑥CH2Cl2 .
A.①③⑥
B.②③⑤
C.全部
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氯化铵晶体受热变成气体是升华
B.过氧化钠的水溶液呈碱性,故滴入酚酞的现象只是变红色
C.98%以上的浓硝酸在空气中会产生白烟,所以叫发烟硝酸
D.水玻璃除用作建筑材料外,还可以用作防腐材料和耐火材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com