
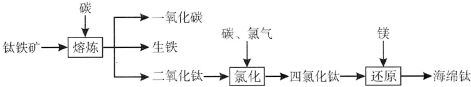
分析 根据题中提取金属钛(海绵钛)的主要工艺流程图可知,钛铁矿被碳还原后得二氧化钛,二氧化钛再与碳、氯气反应得四氯化钛和一种可燃性气体为CO,四氯化钛再被还原得到钛,
(1)根据元素守恒可写出化学方程式,提纯四氯化钛的方法是过滤、蒸馏;
(2)镁在高温条件下与TiCl4反应制得钛和氯化镁;
(3)钛在高温下易被氧化,所以制取钛时应防止钛被氧化;
(4)比较氢氟酸与水、稀盐酸、稀H2SO4或稀HNO3的性质差异可判断;
(5)硝酸与镁反应生成氮的氮化物,会污染环境,根据样品中除去镁后质量减少十分之一,即镁的质量也钛的质量之比为1:9,据此可计算出钛和镁的物质的量之比;
解答 解:根据题中提取金属钛(海绵钛)的主要工艺流程图可知,钛铁矿被碳还原后得二氧化钛,二氧化钛再与碳、氯气反应得四氯化钛和一种可燃性气体为CO,四氯化钛再被还原得到钛,
(1)在高温条件下二氧化钛、碳粉、氯气制得TiCl4和CO,该反应的化学方程式为TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO,提纯四氯化钛的方法是过滤、蒸馏,
故答案为:TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO;蒸馏;
(2)镁在高温条件下与TiCl4反应制得钛和氯化镁,反应方程式为2Mg+TiCl4$\frac{\underline{\;高温\;}}{\;}$2MgCl2+Ti,
故答案为:2Mg+TiCl4$\frac{\underline{\;高温\;}}{\;}$2MgCl2+Ti;
(3)钛在高温下易被氧化,所以制取钛时应隔绝空气或在稀有气体条件下进行,防止钛被氧化,
故答案为:隔绝空气或在稀有气体环境;
(4)比较氢氟酸与水、稀盐酸、稀H2SO4或稀HNO3的性质可知,氢氟酸的酸性弱于盐酸或硫酸等,故A错误,氧化性也弱于硝酸,故B错误,钛与氢氟酸反应,氢氟酸显示氧化性,故C错误,所以钛易溶于氢氟酸,是因为钛离子易与氟离子形成可溶性难电离物质,
故选D;
(5)硝酸与镁反应生成氮的氮化物,会污染环境,且耗酸量多,根据样品中除去镁后质量减少十分之一,即镁的质量也钛的质量之比为1:9,所以钛和镁的物质的量之比为$\frac{1}{24}$:$\frac{9}{48}$=2:9,
故答案为:污染环境,且耗酸量多;2:9.
点评 本题主要考查了钛的制取和提纯,涉及化学方程式的书写、实验条件的选择、工业流程的分析,综合性较强,难度较大,对学生的分析问题、解决问题的能力要求较高.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使石蕊溶液变红的溶液中:MnO4-、NO3-、SO42-、Na+、SO32- | |
| B. | 加入Al能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、SO42- | |
| C. | 使pH试纸变深蓝的溶液中:CO32-、NO3-、Na+、S2-、AlO2-、SO32- | |
| D. | pH=1的溶液中:Fe2+、Al3+、NO3-、I-、Cl-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2作为氧化剂得到的电子数为N0 | |
| B. | 1.0 mol•L-1 NaAlO2溶液中含有Na+数目为N0 | |
| C. | 1 mol的甲基与1 mol的羟基所含电子数均为9N0 | |
| D. | 92 g NO2、N2O4混合气体含有的分子数为2N0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,同一时间内阳极溶解铜的质量比比阴极析出铜的质量小 | |
| B. | 高炉炼铁时,增加高炉高度,延长CO和铁矿石的接触时间,可以提高CO利用率 | |
| C. | 硫酸工业中,接触室内安装热交换器,是为了将SO2完全转化为SO3 | |
| D. | 侯氏制碱是将CO2和NH3先后通入饱和氯化钠溶液中得碳酸氢钠固体,再灼烧制碳酸钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键 | |
| B. | SiO2晶体中每个硅原子与两个氧原子以共价键相结合 | |
| C. | 金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低 | |
| D. | 晶体中分子间作用力越大,分子越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | P3>P4,y轴表示A的转化率 | |
| B. | P3>P4,y轴表示B的质量分数 | |
| C. | P3>P4,y轴表示混合气体密度 | |
| D. | P3<P4,y轴表示混合气体的平均相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na[Au(CN)2]可溶于水 | |
| B. | 化合物Na[Au(CN)2]中金元素的化合价为+2 | |
| C. | 金化学性质稳定,不与任何物质反应 | |
| D. | 在提炼过程中含金元素的物质始终作氧化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com