

| A. | P3>P4,y轴表示A的转化率 | |
| B. | P3>P4,y轴表示B的质量分数 | |
| C. | P3>P4,y轴表示混合气体密度 | |
| D. | P3<P4,y轴表示混合气体的平均相对分子质量 |
分析 由图(1)可知,压强为P2时,温度T1先到达平衡,故温度T1>T2,且温度越高,平衡时C的质量分数越低,故升高温度平衡向逆反应移动,正反应为放热反应;
温度为T1时,压强P2先到达平衡,故压强P2>P1,且压强越大,平衡时C的质量分数越高,故增大压强平衡向正反应移动,正反应为体积减小的反应,故x=1,
由图(2)可知,升高温度,平衡向逆反应方向移动,y值减小,则y可为A、B的转化率、C的体积分数等,结合压强对平衡移动的影响分析.
解答 解:由图(1)可知,压强为P2时,温度T1先到达平衡,故温度T1>T2,且温度越高,平衡时C的质量分数越低,故升高温度平衡向逆反应移动,正反应为放热反应;
温度为T1时,压强P2先到达平衡,故压强P2>P1,且压强越大,平衡时C的质量分数越高,故增大压强平衡向正反应移动,正反应为体积减小的反应,故x=1,则:
A.如果P3>P4,在相同温度下增大压强平衡向正反应方向移动,则A的转化率增大,同时升高温度平衡向逆反应方向移动,A的转化率降低,图象与实际符合,故A正确;
B.P3>P4,增大压强,平衡向正反应移动,B的质量分数减小,同时升高温度平衡向逆反应方向移动,B的质量分数应增大,图象与实际不符,故B错误;
C.混合气体的总质量不变,容器的体积不变,混合气体的密度不变,故C错误;
D.P3<P4,增大压强,平衡向正反应移动,混合气体总的物质的量减小,混合气体的总质量不变,平均式量增大,温度升高平衡向逆反应移动,混合气体总的物质的量增大,平均式量减小,图象与实际不相符,故D错误;
故选A.
点评 本题考查化学平衡图象、化学平衡的影响因素等,难度中等,注意根据图(1)分析反应的特征是解题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
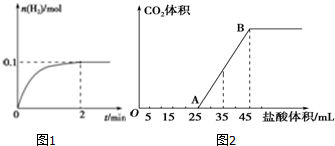
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
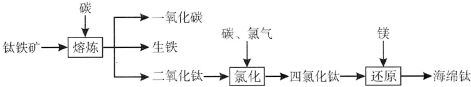
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
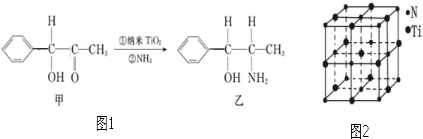
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
 ;该反应的反应类型是取代反应.
;该反应的反应类型是取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 牛油、纤维素和蛋白质都是天然高分子化合物 | |
| B. | 淀粉属于糖类 | |
| C. | 石油、植物油都只含有C、H两种元素 | |
| D. | 蛋白质遇硫酸铜溶液后产生的沉淀能重新溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液 | B. | 新制的Cu(OH)2悬浊液 | ||
| C. | 碘水 | D. | 溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com