
【题目】如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法错误的是( ) 
A.锌是负极,电子从锌片经导线流向铜片
B.氢离子在铜片表面被还原
C.如果将硫酸换成橙汁,导线中不会有电子流动
D.装置中存在“化学能→电能→光能”的转换
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中粒子的物质的量浓度关系正确的是( )
A. 0.1mol/|LCH3COONa 与0.lmol/LHCl 溶液等体积混合: c(Na+)=c(Cl-)>c(OH-)>cCH3COO-)
B. 0.lmol/LNH4Cl与0.lmol/L 氨水等体积浪合(pH>7): c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
C. 0.1mol/LNa2CO3与0.lmol/LNaHCO3溶液等体积混合:2/3c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D. 0.1mol/LNa2C2O4与0.lmol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂-空气电池具有能量密度高的优点,有望成为新能源汽车的电源,其结构如右图所示,其中固体电解质只允许Li+通过。下列说法正确的是

A. 放电时,负极反应式:Li-e-+OH-=LiOH
B. 放电时,当外电路中有1 mol e-转移时,水性电解液离子总数增加NA
C. Li+穿过固体电解质向正极移动而得到LiOH溶液
D. 应用该电池电镀铜,阴极质量增加64 g,理论上将消耗11.2 L O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。

填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):________________________。
(2)试管C中苯的作用是 。反应开始后,观察D和E两试管,看到的现象分别为 、 。
(3)反应2~3 min后,在B中的NaOH溶液里可观察到的现象是 。
(4)在上述整套装置中具有防倒吸作用的仪器有 (填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】既可以用来鉴别甲烷和乙烯,又可以用来除去甲烷中混有的少量乙烯的操作方法是( )
A.混合气通过盛酸性高锰酸钾溶液的洗气瓶
B.混合气通过盛足量溴水的洗气瓶
C.混合气通过盛蒸馏水的洗气瓶
D.混合气跟适量氯化氢混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验①0.1 mol·L-1AgNO3溶液和0.1 mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀C;②向滤液b中滴加0.1 mol·L-1KI溶液,出现浑浊;③向沉淀C中滴加0.1 mol·L-1KI溶液,沉淀变为黄色。
下列分析不正确的是
A. 浊液a中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+C1-(aq)
Ag+(aq)+C1-(aq)
B. 滤液b中不含Ag+
C. ③中颜色变化说明AgCl转化为AgI
D. 实验可以证明AgI比AgCl更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。一旦泄露需要及时处理,一般可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染。
I.已知:氰化钠化学式为NaCN,氰化钠是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,
易水解生成氰化氢。
(1)CN-中C元素显+2价,N元素显-3价,则非金属性N_______C(填“<”“>”或“==”),请设计实验证明:___________________________________________________________________________。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是________________________________________________________。
I.硫代硫酸钠的工业制备的反应原理为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学兴趣小组用上述原理实验室制备硫代硫酸钠,并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【查阅资料】
ⅰ.Na2S2O3易溶于水,其稀溶液与BaCl2溶液混合物有沉淀生成。
ⅱ.Na2S2O3易被氧化;BaSO3难溶于水,可溶于稀盐酸。
【实验一】实验室通过如下图所示装置制备Na2S2O3。
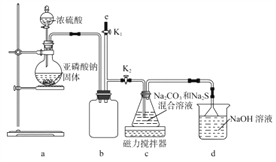
(1)实验中要控制SO2生成速率,可采取的措施有____________(写出一条)。
(2))b装置的作用是____________________________。
(3)反应开始后,c中先有淡黄色浑浊产生,后又变为澄清,此浑浊物为________(填化学式)。
(4)实验结束后,在e处最好连接盛__________(填“NaOH溶液”、“水”、“CCl4”中的一种)的注射器,接下来的操作为__________,最后拆除装置。
(5)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_____________________________________。若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:
①废水中氰化钠的最高排放标准为0.50 mg·L-1;
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先于Ag+反应。
实验如下:取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol·L-1的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
(6)滴定时1.000×10-4mol·L-1的标准AgNO3溶液应用_______(填仪器名称)盛装;滴定终点时的现象是_______。
(7)处理后的废水是否达到排放标准:_______ (填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器里,A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示,已知3v(B)=2v(A)、2v(C)=3v(B),则此反应可表示为( )
A.2A+3B=2CB.A+3B=2CC.3A+2B=3CD.A+B=C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.研究CO2、CO的利用对促进低碳社会的构建具有重要意义,CO2、CO都可用于合成甲醇。CO2用于合成甲醇的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
①该反应的平衡常数表达式为K=____________________。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如右图所示,则该反应的ΔH_______0(填“>”、“<”或“=”)。

Ⅱ.甲醇是结构最为简单的饱和一元醇,又称“木醇”或“木精”。甲醇是一碳化学基础的原料和优质的燃料,主要应用于精细化工、塑料、能源等领域。
已知甲醇制备的有关化学反应如下
反应①:CO(g)+2H2(g)=CH3OH(g) △H1=﹣90.77kJmol—1
反应②:CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.19kJmol—1
反应③:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H3
(1)反应③的△H3=__________________。
(2)若500℃时三个反应的平衡常数依次为K1、K2与K3,则K3=_____(用K1、K2表示)。已知500℃时K1、K2的值分别为2.5、1.0,并测得该温度下反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O (g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时 V正_____ V逆(填“>”、“=”或“<”).
(3)在3L容积可变的密闭容器中发生反应②,c(CO)随反应时间t变化如图中曲线Ⅰ所示。若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。

当曲线Ⅰ变为曲线Ⅱ时,改变的条件是_______。当通过改变压强使曲线Ⅰ变为曲线Ⅲ时,曲线Ⅲ达到平衡时容器的体积为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com